Definición de Ciclo del Nitrógeno

Licenciado en Biología
El nitrógeno forma parte de moléculas orgánicas que son fundamentales para la vida: los ácidos nucleicos ADN y ARN y las proteínas. El nitrógeno es un elemento crítico en el crecimiento vegetal y para el correcto desarrollo de todos los organismos.
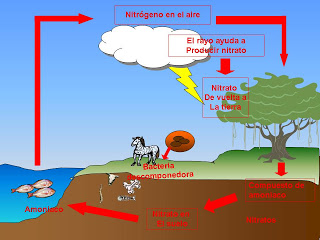 En la Tierra, el nitrógeno (N) puede encontrarse en una variedad de lugares denominados reservorios. Un reservorio es un lugar donde el nitrógeno se almacena y permanece algún tiempo. El proceso constituye un ciclo biogeoquímico, porque el movimiento del nitrógeno entre la biósfera, la atmósfera y la hidrósfera implica reacciones químicas
En la Tierra, el nitrógeno (N) puede encontrarse en una variedad de lugares denominados reservorios. Un reservorio es un lugar donde el nitrógeno se almacena y permanece algún tiempo. El proceso constituye un ciclo biogeoquímico, porque el movimiento del nitrógeno entre la biósfera, la atmósfera y la hidrósfera implica reacciones químicas
En los últimos años, las actividades humanas han interferido con el ciclo del nitrógeno, generando fuentes no naturales de este elemento. Las fuentes artificiales de nitrógeno han permitido aumentar la productividad de la agricultura, pero también se ha desbordado la capacidad del ciclo para recircular el nitrógeno, lo que está generando problemas ambientales.
Reservorios de nitrógeno
El principal reservorio de nitrógeno es la atmósfera. El nitrógeno molecular (N2), constituye aproximadamente el 78% de los gases atmosféricos. Este nitrógeno atmosférico es muy poco reactivo, es decir, no forma otras moléculas con facilidad. En esta forma, casi ningún ser vivo puede utilizar el nitrógeno, y por esto, el N2 se conoce como nitrógeno no reactivo.
En la biósfera, el nitrógeno forma parte de la biomasa, principalmente como proteínas, que son las moléculas estructurales por excelencia de los seres vivos. Esto quiere decir que el cuerpo de cualquier organismo está, mayoritariamente, formado por proteínas.
Los organismos obtienen el nitrógeno de su alimento y lo incorporan a sus estructuras celulares, pero no pueden utilizar el N2.
Algunas bacterias, mediante reacciones metabólicas, trasforman el N2 en formas de nitrógeno reactivo o nitrógeno biodisponible que sí pueden ser utilizadas por los seres vivos.
Esto se conoce como fijación de nitrógeno, y el único proceso natural que fija nitrógeno es la fijación bacteriana. Estas bacterias están en el suelo y en el agua, y las plantas pueden absorber este nitrógeno reactivo por sus raíces. Luego, los animales incorporan el nitrógeno comiéndose a las plantas, o comiendo otros animales.
Al morir, el nitrógeno orgánico de los seres vivos vuelve al suelo o al agua, donde puede ser reutilizado.
En la hidrosfera, el nitrógeno está disuelto en los océanos y aguas continentales, en forma de compuestos reactivos de nitrógeno: nitratos (NO3-), nitritos (NO2-) y amonio (NH4+). Estos compuestos provienen de la fijación biológica, de la descomposición de materia orgánica y del escurrimiento de fertilizantes.
Etapas y elementos partícipes
El nitrógeno atmosférico (N2) es un gas inerte y, como ya hemos dicho, no es biodisponible, es decir, no puede ser utilizado por los seres vivos. Solo un tipo de bacterias puede convertirlo en compuestos reactivos y biodisponibles.
Estas bacterias se conocen, valga la redundancia, como bacterias fijadoras de nitrógeno, y son la única vía de entrada del nitrógeno a la biota.
Las bacterias convierten el N2 en amoniaco (NH3) y amonio (NH4+). Estas formas de nitrógeno ya pueden ser aprovechadas por las plantas, pero también por otras bacterias que generan nitratos (NO3-) y nitritos (NO2-). Todas estas formas de nitrógeno pueden ser usadas por los seres vivos, y son muy solubles en agua. El amoniaco y el nitrato son tóxicos en altas concentraciones.
Los compuestos de nitrógeno reactivo son absorbidos por las plantas, que lo utilizan para crear sus proteínas. Luego, el nitrógeno (ya convertido en formas orgánicas) pasa a través de las cadenas tróficas del ecosistema. Después de la muerte de los organismos, las bacterias descomponedoras convierten el nitrógeno orgánico presente en los restos en amonio (NH4), en un proceso conocido como amonificación.
El amonio puede ser absorbido por las plantas o convertido en nitritos y nitratos, que también pueden ser usados por las plantas.
Otras bacterias convierten los nitratos en nitrógeno molecular (N2), devolviéndolo a la atmósfera y cerrando el ciclo. Este proceso se llama desnitrificación.
Hasta acá hemos descrito el ciclo natural del nitrógeno.
Influencias antrópicas en el ciclo del nitrógeno
La importancia industrial de disponer de un mecanismo artificial de fijación de nitrógeno era indudable: al no depender de las bacterias y del ciclo natural para generar formas de nitrógeno biodisponibles, se podría usar ese nitrógeno fijado artificialmente para aumentar la productividad de la agricultura.
El proceso de fijación artificial de nitrógeno se formuló en la primera década del siglo XX y se conoce como el procedimiento de Haber-Bosch. Estos investigadores recibieron premios nobeles de química por su descubrimiento, que permitió producir amonio a escala industrial.
Este amonio se usa principalmente como fertilizante para la agricultura. Pero el uso excesivo de estos fertilizantes aporta grandes cantidades de nitrógeno reactivo al ecosistema, y las bacterias desnitrificantes no dan abasto para convertirlo en nitrógeno molecular no reactivo.
Es decir, el ciclo está desequilibrado: entra mucho más nitrógeno reactivo de lo que los procesos naturales son capaces de devolver a la atmósfera. La consecuencia de esto es que el amoniaco, el nitrito y el nitrato se acumulan en el suelo y el agua.
El nitrato, en altas concentraciones es tóxico para los animales, y puede contaminar el agua de consumo. En las aguas superficiales, sobre todo en lagos, el exceso de formas de nitrógeno reactivo puede provocar eutrofización.
En la eutrofización, el exceso de nutrientes estimula el crecimiento descontrolado de algas. Las aguas eutrofizadas se ven como si estuvieran cubiertas de una capa verde brillante o verde-azulada.
Estas algas pueden agotar el oxígeno disuelto en el agua y ocasionar la muerte de los animales acuáticos por asfixia, también bloquean el sol para las plantas que podrían estar creciendo debajo y algunos tipos de algas liberan toxinas al agua, que envenenan a los animales y hacen que el agua requiera un tratamiento muy agresivo (mucho cloro), para poderla consumir.
Los rayos pueden hacer que el nitrógeno molecular de la atmósfera se convine con el oxígeno, y forme óxidos de nitrógeno; pero este es un proceso que, naturalmente, genera muy poca cantidad de óxidos de nitrógeno.
Pero la quema de combustibles fósiles y el escape de los motores a combustión libera óxidos de nitrógeno a la atmósfera. Los óxidos de nitrógeno son gases que contribuyen a la formación de smog y, cuando se combinan con el agua de las nubes, forman ácidos, que precipitan junto al agua como lluvia ácida. Los óxidos de nitrógeno son gases tóxicos que afectan la salud respiratoria.
Disponer de una fuente artificial de nitrógeno biodisponible sin dudas ha sido benéfico, pero también ha generado un desequilibrio en el ciclo. Las fuentes artificiales de óxidos de nitrógeno han aumentado considerablemente la concentración de estos gases tóxicos en la atmósfera.
Estos desbalances tienen consecuencias graves para los ecosistemas y la biodiversidad, pero también pueden representar un problema de salud para la población.

Art. actualizado: Mayo 2024; sobre el original de diciembre, 2013.
Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.