Definición de Fórmula Química

M.C. en Ingeniería y Física Biomédicas
Las fórmulas químicas son expresiones que representan la composición de moléculas y compuestos iónicos utilizando símbolos químicos, indicando que no son elementos aislados, sino que se encuentran unidos por enlaces. Existen diferentes tipos de fórmulas químicas, las más utilizadas, comúnmente, son la fórmula molecular, estructural y la empírica. A continuación, se explica cada una de ellas a detalle.
Fórmula Molecular
La fórmula molecular de un compuesto indica el número exacto de átomos de cada elemento presentes en la unidad más pequeña representativa de una sustancia, es decir, una molécula. Este tipo de fórmula es con la que se representan los compuestos de manera formal en la mayoría de los textos educativos y especializados, por lo tanto, es la que se encuentra con más frecuencia. La razón es que, cada compuesto, independientemente de su parecido con otro de su misma clase, tendrá una fórmula molecular particular. Así, es muy poco probable que dos compuestos sean descritos con la misma fórmula molecular, lo que no ocurre con la fórmula empírica, la cual se aborda en las secciones siguientes.
La fórmula molecular de un compuesto se constituye de los símbolos de los elementos, presentes en la molécula, acompañados cada uno con números enteros, como subíndices, indicando la cantidad de átomos de tal elemento en la molécula, si solo hay un átomo de algún elemento, por convención, se omite el número 1. Un ejemplo es la fórmula molecular del agua, H2O, donde el oxígeno no cuenta con subíndice, ya que solo hay un átomo en la molécula. Existen moléculas que se componen de más de un átomo del mismo elemento, como el H2, llamado hidrogeno molecular, o el O2, que conocemos como oxígeno molecular, y es el gas que se encuentra en el aire que respiramos, aquí, el subíndice 2, denota que en la molécula hay dos átomos enlazados. El ozono, con fórmula molecular O3, contiene un átomo más que el oxígeno molecular, este tipo de moléculas son alótropos, distintas formas de moléculas formadas por el mismo elemento. Otros alótropos conocidos son el carbón y el diamante, ambos conformados por carbono (C), en diferentes proporciones, lo que los hace completamente diferentes a simple vista.
Fórmula estructural
La fórmula estructural de un compuesto contiene la misma información que una fórmula molecular, con la diferencia que la fórmula estructural muestra el acomodo de los átomos y como se encuentran conectados para formar la molécula. Este tipo de fórmula química generalmente se utiliza para representar moléculas con enlaces covalentes, como los hidrocarburos, por ejemplo, el metano, que se muestra a continuación:
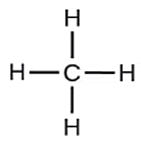
Las líneas representan los enlaces químicos entre átomos, también se ven representados los elementos por su símbolo correspondiente.
Fórmula Empírica
Una fórmula empírica está conformada por los símbolos de los elementos químicos presentes en el compuesto, y subíndices indicando el número relativo de átomos de cada elemento constitutivo, cuando este número es igual a uno, el subíndice se omite. Las fórmulas empíricas suelen ser la forma más simple para representar a un compuesto, se pueden ver como una reducción de las fórmulas moleculares. A menudo se dice que la fórmula molecular de un compuesto es la fórmula “verdadera” pues al saberla se puede obtener la fórmula empírica, lo que no funciona a la inversa, entonces, ¿cuál es su utilidad? Este tipo de fórmulas resulta especialmente útil en casos en los que la estructura molecular no está del todo determinada o las sustancias no están compuestas por moléculas “verdaderas”. Por ejemplo, en compuestos iónicos como la sal de mesa, que se conforma por iones de sodio (Na) y cloro (Cl), su fórmula empírica será NaCl. Cuando se descubre un nuevo compuesto, por lo general, los químicos parten de la fórmula empírica, y después, determinan la molecular.
Existe un tipo de fórmula empírica que representa la composición de miembros pertenecientes a una clase entera de compuestos, se conoce como fórmula general. Una clase de compuestos que pueden ser descritos a partir de luna formula general son las parafinas, hidrocarburos que se utilizan para fabricar velas, los elementos constitutivos de cualquier parafina son carbono (C) e hidrogeno (H), dónde el número de átomos de hidrógeno siempre será el doble, o más, que el número de átomos de carbono. La fórmula general para las parafinas es CnH2n+2, “n” representa cualquier número entero. En este sentido, existen compuestos con diferentes cantidades de átomos de cada elemento y, por lo tanto, diferentes fórmulas moleculares que comparten la misma fórmula empírica por pertenecer a la misma clase. Un ejemplo, son el etileno y propileno, hidrocarburos pertenecientes a la familia de los alcanos, con fórmulas moleculares C2H4 Y C3H6, respectivamente. La fórmula empírica para ambos será CH2, pues la proporción 1:2 de carbono a hidrógeno se mantiene. Por otro lado, hay compuestos para los que su fórmula molecular y empírica son las mismas, por ejemplo, el agua, cuya fórmula, tanto molecular como empírica, es H2O.

Art. actualizado: Oct. 2023; sobre el original de junio, 2014.
Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.