Definición de Azeótropos

Ingeniera Química
Los azeótropos son mezclas de compuestos químicos, con composición definida, que ebulle a temperaturas determinadas. La característica fundamental es que la mezcla se comporta como si fuese una única sustancia pura, conservando sus propiedades y proporcionando facilidades en su manejo.
La mezcla puede estar dada por dos o más componentes y su composición es la misma tanto en fase líquida como fase gaseosa, esto genera similitudes con las sustancias puras. A partir de esto, es fácilmente deducible que esta mezcla no puede ser separada en sus componentes mediante procesos como destilaciones fraccionadas ya que, como se mencionó anteriormente, conservará sus proporciones, comportándose como si fuese un único componente.
Otra característica, es que el punto de ebullición de esta mezcla puede ser mayor, menor o incluso igual al de alguno de sus componentes. Cuando el azeótropo hierve a una temperatura de ebullición máxima, se lo conoce como azeótropo de máxima y cuando lo hace a la menor temperatura posible se lo conoce como azeótropo de mínima. Esto quiere decir, que el azeótropo de mínima tiene un punto de ebullición menor al de sus componentes puros y a la inversa con el azeótropo de máxima. Por ejemplo, en la mezcla metanol – benceno, el azeótropo es de mínima (0,61 benceno – 0,39 metanol en fracciones molares) cuyo punto de ebullición es 58 °C, en tanque que, el punto de ebullición del benceno es 80 °C y el del metanol 65 °C.
Azeótropos de mínima y de máxima
Ahora bien… ¿de dónde surge un azeótropo? Cuando existe una desviación de la Ley de Raoult, es decir, la presión de vapor de la mezcla azeotrópica no se condice directamente con su fracción molar, es cuando surge el concepto de mezcla azeotrópica. Estas desviaciones se producen cuando los componentes se atraen o se repelen significativamente entre sí, es decir, las fuerzas intermoleculares son muy diferentes en los diferentes compuestos.
Cuando la desviación es positiva, se tiene el azeótropo de mínima, mientras que, si la desviación es negativa, se tiene el azeótropo de máxima. Para entender mejor este concepto veamos algunos gráficos:
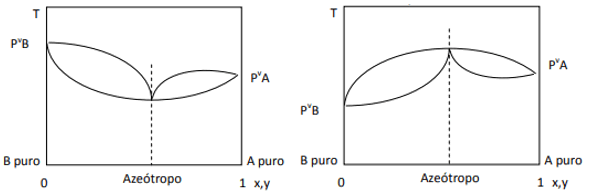
Aquí observamos que, si la mezcla fuese ideal, por Ley de Raoult, las presiones de vapor de los componentes puros deberían unirse mediante una línea recta, pues bien, existe una desviación de esa ley que provoca la formación de azeótropos de mínima y de máxima, dependiendo si existe mayor o menor afinidad entre los componentes. Cuando la desviación a la ley de Raoult es negativa, como en la figura de la izquierda, es un mínimo en el diagrama de presión, pero un máximo en el diagrama de temperatura (por ello, azeótropo de máxima). En cambio, si la desviación es positiva a la Ley de Raoult, será un máximo en el diagrama de presión vs. composición, pero un mínimo en el diagrama de temperatura vs. composición (aquí se tiene un azeótropo de mínima). No hay que confundir diagramas presión vs. composición y temperatura vs. composición.
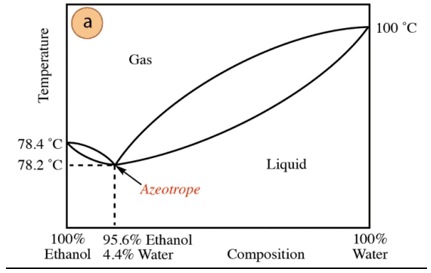
En el caso de la mezcla etanol – agua se tiene un azeótropo de mínima cuya composición es 95,6 % etanol y 4,4 % agua. La temperatura de ebullición de la mezcla azeotrópica es 78,2 °C inferior a la de los componentes puros. Entonces, supongamos destilar una mezcla agua-etanol con alto contenido de agua (cercano al 100 %). No será posible la obtención de alcohol puro, ya que en cada etapa de destilación se irán obteniendo fracciones mayores de etanol, pero nunca llegando al 100%, se irá acercando hacia la composición de la mezcla azeotrópica (el punto más bajo). Es por ello que, como el agua, tiene tendencia a formar azeótropos de mínima con los compuestos orgánicos (dada el tipo de fuerzas intermoleculares que interactúan), es requerido quitar el agua previamente de la mezcla para la obtención del compuesto puro. O bien, una vez obtenido el azeótropo se requieren métodos de extracción de agua adicionales.
En función de lo anterior, no es casual encontrar alcohol (en el supermercado y farmacia) al 95 %, es el producto más económico que se puede obtener. Para obtención del alcohol puro, es necesario “romper” el azeótropo con técnica adicionales, como puede ser uso de agentes secantes o bien destilaciones azeotrópicas. La destilación azeotrópica consiste en adicionar un componente extra en la mezcla que actúe por arrastre y por interacción con alguno de los componentes de la mezcla (mayor afinidad) pueda ser quitado de la mezcla.

Trabajo publicado en: Abr., 2022.
Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.