Significado de espín del electrón Definición, y características

Licenciada en Física
Definición formal
El espín del electrón es un atributo asociado al electrón y otras partículas subatómicas, del mismo modo que lo son la masa y la carga, razón por la que tiene un valor fijo, entendido como un aspecto enteramente cuántico, que es posible imaginarlo, en parte, a partir de concebirlo como una pequeña esfera que simultáneamente rota alrededor del núcleo y de su propio eje, tal como lo hace, por ejemplo, la Tierra.
El espín (del inglés “spin”, que se traduce a giro) es precisamente la rotación del objeto sobre su eje. Sin embargo, hay que aclarar bien que el electrón no es, en modo alguno, un objeto extendido, ni siquiera uno de pequeño tamaño. Y ocurre que a esas escalas tan, pero tan pequeñas, las cosas no se comportan como lo hacen en el mundo macroscópico.
Por eso surgen algunos fenómenos que no se ajustan a lo que se suele observar. Y el espín del electrón es uno de ellos.
Para empezar, la posición de algo tan minúsculo como el electrón no se puede conocer con precisión infinita, únicamente se tiene la probabilidad de encontrarlo en determinado orbital alrededor del núcleo.
Y además el giro del electrón se caracteriza por un momento angular orbital cuantizado, es decir, que solo puede tener determinados valores. Y como el electrón no tiene un tamaño extendido, no puede rotar “sobre sí mismo” a modo de planeta, sino que más bien el electrón rota “en sí mismo”, porque ni ocupa una determinada posición en el espacio ni tiene un tamaño mensurable.
Pero lo cierto es que esta rotación del electrón en sí mismo es un hecho observado experimentalmente. Y, por supuesto, tiene su momento angular intrínseco o de espín, que está cuantizado.
La cuantización del momento angular es otro fenómeno que no existe en el mundo macroscópico, pues el momento angular de un cuerpo extendido se puede modificar a cualquier valor, haciéndolo girar más o menos rápido.
Características del momento angular de espín
Denotando como \(\vec{S}\) al momento angular de espín del electrón, la evidencia experimental indica que su magnitud viene dada por el valor fijo:
\(S=\sqrt{\frac{1}{2}\left( \frac{1}{2}+1 \right)}\hbar =\sqrt{\frac{3}{4}}\hbar \)
El símbolo ħ es la constante de Planck dividida entre 2π. La constante de Planck fue descubierta por el físico alemán Max Planck (1858-1947) y vale 6,626 070 15 × 10-34 J.s. Es una de las constantes más importantes de la naturaleza.
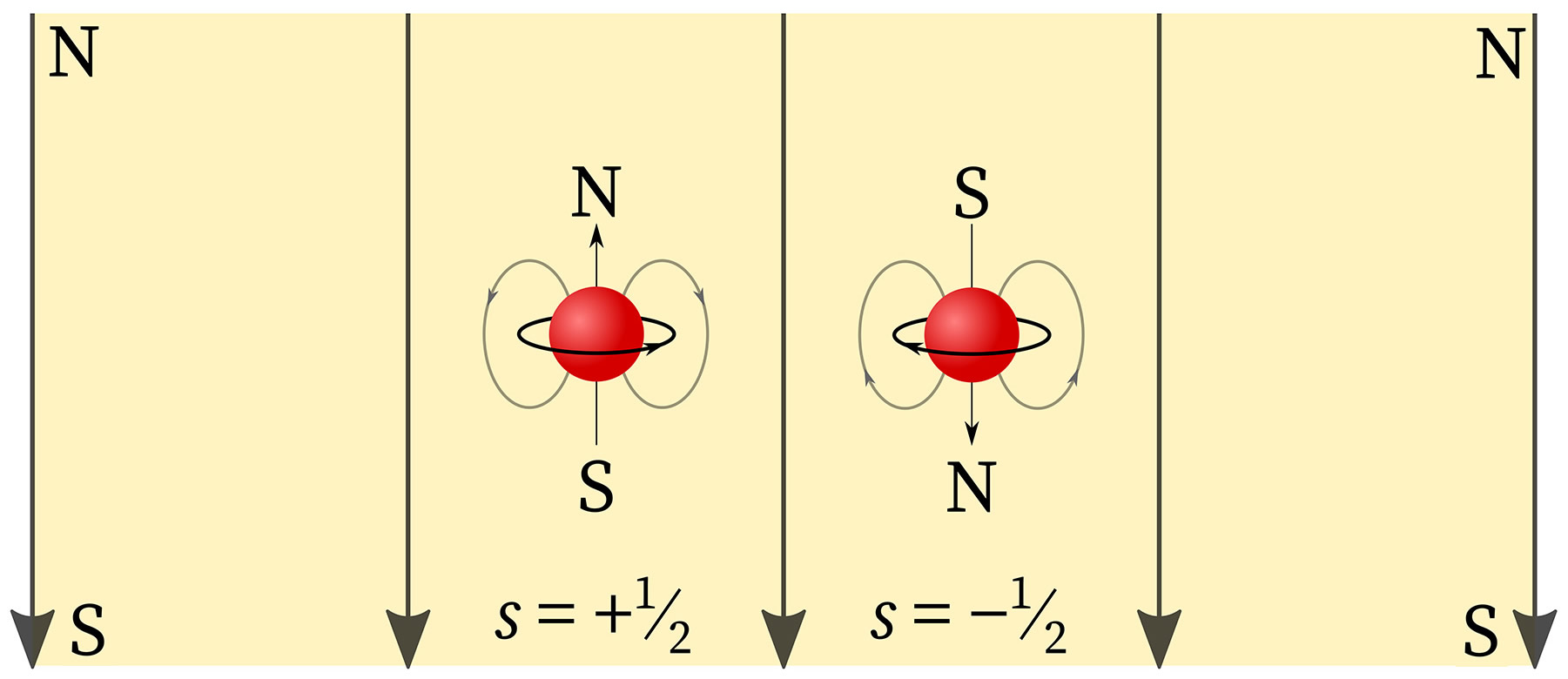
Una componente de dicho vector \(\vec{S}\) en cualquier dirección, por ejemplo, la componente z llamada \({{S}_{z}}\), solamente tiene dos valores posibles, por supuesto en términos de ħ:
\({{S}_{z}}=\pm \frac{1}{2}\hbar \)
Esta característica tan notable del electrón, de presentar solo dos valores constantes del momento angular de espín, sugiere que se puede utilizar para almacenar información.
De hecho, la espintrónica, o electrónica del espín, una nueva rama de la tecnología, ya hace uso de esta propiedad, puesto que el espín del electrón responde fácilmente ante campos magnéticos aplicados. El resultado es una mayor rapidez de respuesta y más capacidad de almacenamiento en dispositivos como computadoras y teléfonos celulares.
Número cuántico de espín
La ecuación anterior indica que al momento angular de espín del electrón se le puede asociar un número cuántico cuyos valores son +1/2 y -1/2. A este número cuántico se le llama simplemente espín.
En efecto, el número cuántico ms, llamado también número magnético (más adelante se explica la razón de llamarlo así), distingue los dos estados de momento angular intrínseco en el electrón, o lo que es igual, las dos posibles orientaciones espaciales para el vector \(\vec{S}\) : hacia arriba y hacia abajo, respectivamente.
De esta forma:
\({{S}_{z}}={{m}_{s}}\hbar \)
Con ms = ± ½.
Fermiones y bosones
Los protones también tienen espín ± ½ y en general, el espín de cualquier partícula es un múltiplo de ½ con signo positivo o negativo: ms = ± n/2, con n=0,1,2,3…). En cambio, el fotón, la partícula portadora de la interacción electromagnética tiene espín 1, mientras que el bosón de Higgs tiene espín 0.
Esto origina que las partículas se clasifiquen en fermiones (en honor a Enrico Fermi, notable físico italiano), que son las que tienen espín semientero, como el electrón, el protón y el neutrón, y los bosones, que tienen espín entero, como el fotón y el bosón de Higgs.
Los fermiones conforman la materia y los bosones son portadores de las interacciones. Se diferencian no solo en el espín, sino también en el hecho de que los fermiones obedecen el principio de exclusión de Pauli y los bosones no.
Para los electrones, seguir el principio de exclusión significa que, en un átomo, dos electrones no pueden tener el mismo conjunto de números cuánticos. Y además, la misma región del espacio solo puede ser ocupada por no más de dos electrones con valores de ms de signo contrario.
El magnetismo y el espín del electrón
El hecho de que al número cuántico ms se le llame número cuántico magnético, señala la existencia de una relación entre el magnetismo y el espín del electrón. Las propiedades magnéticas de la materia se deben al movimiento de los electrones en el átomo.
En efecto, gracias a su movimiento orbital, el electrón se puede considerar como una diminuta espira de corriente con un vector de momento magnético \(\vec{\mu }\). Asimismo, el movimiento de espín es la otra contribución del electrón al magnetismo.
Existe un momento magnético asociado al espín, que se calcula mediante:
\({{\mu }_{z}}=-\left( 2.00232 \right)\frac{e}{2m}{{S}_{z}}\)
Con e = 1.6 ×10−19 C, que es la carga del electrón y m = 9,1×10−31 kg su masa. El valor 2.00232 se denomina razón giromagnética del espín del electrón.
El momento magnético del átomo es la suma del momento magnético de cada uno de sus electrones. Y como todas las sustancias están hechas de átomos, todas exhiben algún tipo de magnetismo, pero los elementos fuertemente magnéticos tienen orbitales electrónicos incompletos, ya que de esta manera no todos los momentos magnéticos se cancelan entre sí.

Trabajo publicado en: May., 2021.
Ilustraciones: ChemistryGod