Significado de materia en estado sólido, líquido, gaseoso, plasmático y CBE Definición, y diferencia
Definición formal
En el lenguaje de la química, cuando se habla de los estados de la materia se hace referencia a los mecanismos internos que afectan a las partículas o moléculas, entendiendo a la materia como una forma física capaz de observarse y que posee una estructura definida.
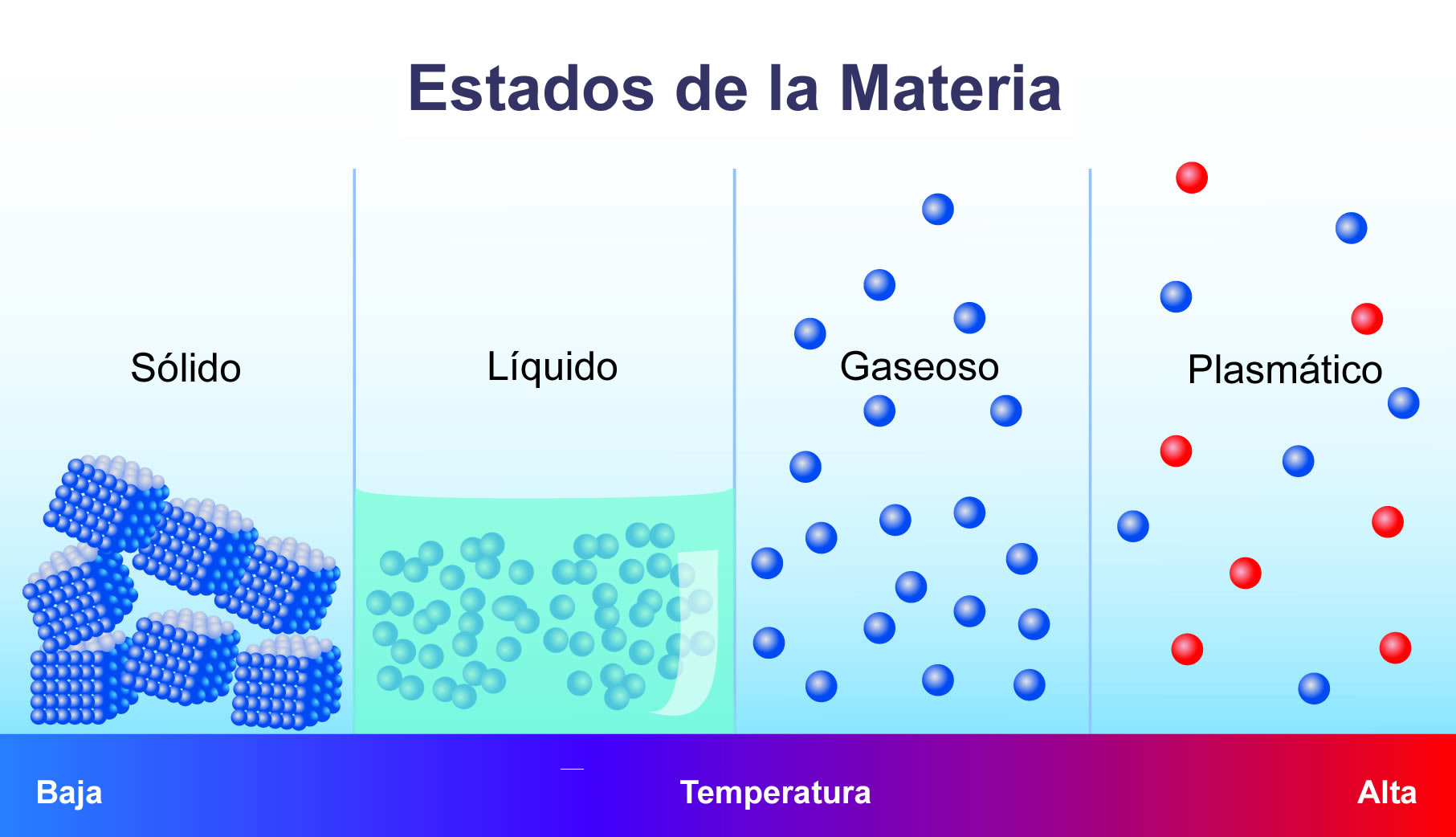
En el estado sólido las moléculas se encuentran más compactas, no presentan un movimiento aparente y tienen un volumen y una forma propia. Observar, también, que cuando un agente varía de una situación de la materia a otra se lo denomina cambio de estado.
En el estado líquido las moléculas están muy próximas unas a otras y su movimiento es de tipo vibracional (en este estado las moléculas sí tienen un volumen pero no una forma definida).
De modo resumido, cuando algo se encuentra en estado gaseoso, las moléculas están muy separadas entre sí y tienen un movimiento que tiende a la dispersión (en consecuencia, los gases carecen de un volumen y de una forma propia).
Luego, en un escalón diferenciado por la complejidad de sus propiedades y la relación con los otros estados, existe la categoría plasmática que expone entre sus ejemplos al sol, que se nutre de la combinación de presiones altas y temperaturas bajas, configurando electrones positivos, y por ende átomos ionizado, o dicho de otra manera, libres que pueden impactar con otros.
Por último, probado en 1995 por los norteamericanos Eric Cornell y Carl Wieman, sobre los trabajos del alemán Wolfgang Ketterle, siendo los tres reconocidos en 2001 con el Nobel en Física, se distingue el denominado Condensado de Bose-Einstein (CBE), que expresa un conjunto de átomos capaz de posicionarse físicamente en el mismo espacio/tiempo. El nombre homenajea a Einstein (1879-1955) y Bose (1894-1974), quienes protagonizaran los primeros acercamientos teóricos.
Una sustancia puede transitar entre los tres estados básicos sin que la composición se modifique, aunque sus propiedades físicas sí pueden hacerlo. El ejemplo más familiar es sin duda el agua, que existe como hielo (sólido), agua líquida y vapor de agua (gas). Agregando calor, un bloque de hielo (sólido) se derrite convirtiéndose en agua líquida. Y si prosigue el calentamiento, el agua líquida finalmente se evapora. Las temperaturas a las cuales suceden estos cambios en el agua se obtienen fácilmente en el entorno, sin embargo, el caso es diferente para otras sustancias. Por ejemplo, para que metales como el hierro o el cobre pasen del estado sólido al líquido, es decir, se fundan, se necesitan temperaturas mucho más elevadas.
Etimológicamente, responde al latín materia, evidenciando raíz en el latín mater, que se lo interpreta para madre, no obstante se aplica en este caso sobre la idea de matriz o fuente de la cual está constituida la cosa. Los antiguos griegos creían que existían cuatro formas fundamentales: fuego, aire, agua y tierra.
El calor y los cambios de estado
Si queremos que un elemento de la naturaleza pase de sólido a líquido, será necesario que incorporemos una cierta cantidad de energía (en este caso el proceso se denomina fusión). Lo mismo sucederá si un elemento cambia de sólido a gaseoso (cuando esto ocurre el proceso se conoce como ebullición). En cualquiera de estos procesos la energía que desencadena el cambio de estado es el calor.
Si queremos transformar un gas en un líquido, el proceso se denomina condensación y se basa en la extracción o liberación del calor. Cuando el cambio pasa de líquido a sólido se produce una congelación.
La temperatura provocada por la acción del calor tiene un impacto directo sobre las moléculas que conforman una sustancia. Así, cuanto mayor sea la temperatura, mayor será la velocidad de movimiento de las moléculas.
Estado Gaseoso
Las moléculas de los gases están muy separadas y esto les otorga una gran movilidad, por eso los gases no tienen una forma delimitada, expandiéndose de inmediato para ocupar la totalidad el volumen que está a disposición. Hay, por tanto, una mayor desorganización entre las moléculas y la energía cinética de ellas, asociada a su movimiento, prevalece sobre la energía potencial.
Ello se debe a que, en los gases, el movimiento de las partículas que los constituyen es variado: desplazamientos y rotaciones que facilitan la compresión o la expansión.
Estado Líquido
En los líquidos las distancias entre las moléculas son menores y hay una mayor organización, por las fuerzas intermoleculares que se encargan de mantener la cohesión. Estas fuerzas son de corto alcance, por eso los líquidos poseen un volumen fijo, aunque pueden adaptarse a la forma del recipiente que los contiene.
La energía cinética de las moléculas en los líquidos es aproximadamente del mismo orden que la energía potencial. Las moléculas tienen menor capacidad de movimiento, pero aún así pueden desplazarse, rotar y vibrar.
Estado Sólido
En este caso las distancias intermoleculares son aún menores y las fuerzas entre las moléculas son más intensas y en la mayor parte de los casos son de largo alcance. Por ello la materia en estado sólido tiene formas bien definidas y es menos deformable.
Naturalmente la energía potencial es mucho mayor que la energía cinética, ya que las fuerzas presentes se encargan de mantener fuertemente cohesionadas a las moléculas. Por ello sus movimientos están limitados a vibraciones y oscilaciones alrededor de posiciones relativamente fijas, dentro de la estructura del sólido.
Estado Plasmático
Es un gas en el cual las partículas constituyentes están ionizadas, es decir, poseen carga neta, ya sea por déficit o por exceso de electrones. Esto les confiere una dinámica muy particular, gracias a las fuerzas electromagnéticas. Por ejemplo una característica importante del plasma es que siempre emite luz y aparte, es buen conductor de la electricidad.
Se puede obtener plasma con una descarga en arco, que se produce entre dos electrodos puestos en el interior de un gas, un hecho conocido desde hace tiempo.
A lo largo del siglo XIX varios experimentadores como Faraday, Crookes y J. J. Thomson estudiaron la descarga de arco en tubos llenos de gas, conduciendo a este último a descubrir al electrón, una de las partículas elementales del átomo.
En la naturaleza y en las cercanías de la Tierra el plasma aparece en los rayos, las auroras boreales y australes y la ionosfera. Se puede observar también en el interior del Sol y en las nebulosas como la de Orión y del Águila, donde la formación estelar es intensa.
Trabajo publicado en: Feb., 2020.
Ilustraciones: Akarat
Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.