Significado de pH Definición, escala, agua, y cuerpo humano

MSc. Licenciada en Química
Definición formal
El pH es la discriminación del nivel de acidez de una solución, interpretándose en base a la concentración de los iones hidrógeno (también reconocidos como protones), los cuales actúan como los agentes responsables por este fenómeno. Por su parte, resulta poco práctico hablar del nivel de acidez en términos de la concentración, en moles por litro (M).
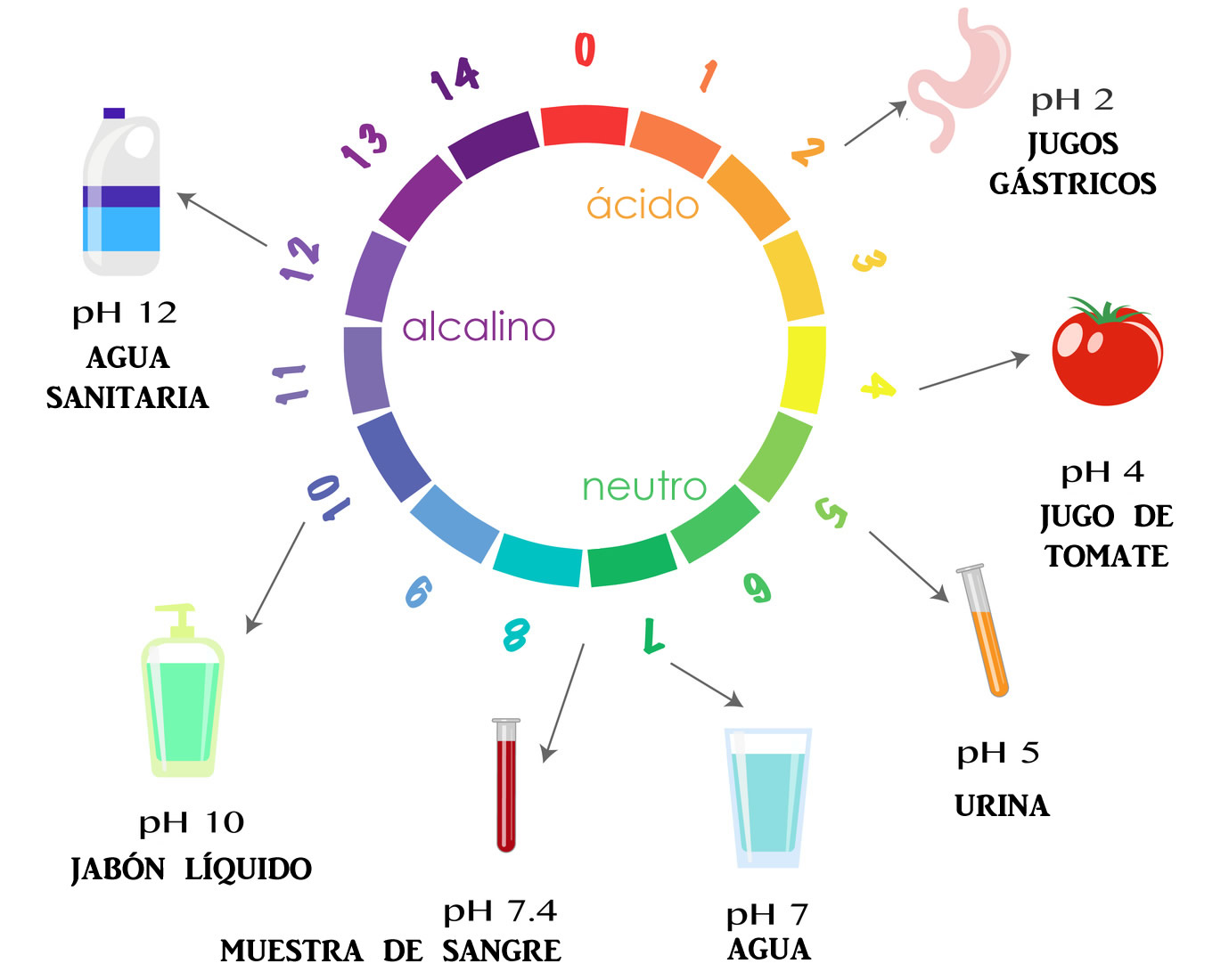
Por ejemplo, el agua pura a 25ºC tiene una concentración de iones H+ igual a 1×10-7 M. Es entonces que, convenientemente, se decidió expresar esta concentración en forma logarítmica y a este valor se le definió como pH, del francés pouvoir hydrogene (“poder de hidrógeno”).
Debido a que, los exponentes de base diez corresponden con los logaritmos de las correspondientes concentraciones, en forma matemática, el pH puede calcular de acuerdo a la siguiente ecuación:
(pH=-logleft[ {{H}^{+}} right])
Nótese que, la concentración de los iones hidrógeno se escribe entre corchetes y siempre debe estar expresada en unidades de moles/litro de solución. Al observar la definición de pH se puede advertir que una variación de pH de apenas una unidad corresponde a una alteración de diez veces sobre la capacidad de iones hidrógeno. De este modo, una solución cuyo pH equivale a 2, resulta diez veces más ácida que una que posee pH 3.
Cómo se concibe la escala de pH
Cuando tomamos los exponentes de las potencias con base diez de la concentración de los iones hidronio y le cambiamos el signo, se obtiene una escala de números enteros y positivos, que es la escala del pH.
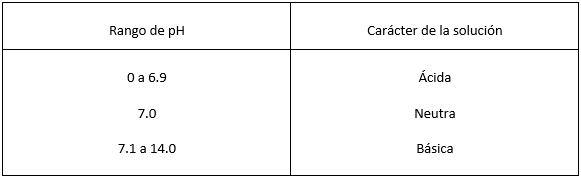
Teniendo como base al agua pura, se designa que una solución neutra tiene un pH de 7. En consecuencia, una ácida tiene un pH menor que 7 y una alcalina (básica) tiene un pH mayor que 7. Cuanto más bajo es el pH, más ácida es la solución, y cuanto más alto es el pH, más básica es la solución.
Asimismo, en el agua pura la concentración de iones hidronio es exactamente igual a la de los iones hidroxilo:
(left[ {{H}_{3}}{{O}^{+}} right]=left[ O{{H}^{-}} right]=1x{{10}^{-7}})
El producto iónico del agua es entonces:
(left[ {{H}_{3}}{{O}^{+}} right]left[ O{{H}^{-}} right]=(1x{{10}^{-7}})x(1x{{10}^{-7}})=1x{{10}^{-14}})
El hecho de que la concentración de iones hidronio sea igual a los iones hidroxilo es muy importante, ya que, de ello depende que el agua sea una sustancia neutra. Y como éste es un valor constante, si la concentración de hidronio aumenta, la de hidroxilo disminuye en esa misma medida, para mantener esta magnitud constante. De allí que el máximo en la escala de pH es 14.
En resumen tenemos:
Indicadores de medición del pH
La determinación práctica del pH implica el uso de sustancias químicas, llamadas indicadores ácido-base. Estos indicadores son colorantes que cambian de color a valores específicos de pH. Cada colorante indicador presenta un color en medio ácido y un color distinto en solución básica y la combinación de varios de estos indicadores exhibe una gama completa de colores a diferentes valores de pH. Esta combinación de indicadores se coloca mediante impregnación en tiras de papel que facilitan su uso. Este papel se conoce como papel tornasol o papel pH.
Existen también, aparatos eléctricos para medidas más exactas de los pH, llamados potenciómetros. Estos instrumentos pueden medir el pH con una precisión de hasta 0.01 unidades de pH. Sin embargo, son más costosos y difíciles de usar que el papel pH.
Autoionización del agua
Cuando pensamos en moléculas de agua, imaginamos H2O. Sin embargo, hasta el agua más pura no es completamente H2O, tiene pequeñas porciones de iones. ¿Sabías que una de cada quinientas millones de molécula de agua transfiere un ion hidrógeno (o protón) a otra? Y producto de este intercambio se forma el ion hidronio (H3O^+) y el ion hidroxilo (OH–). Esto se puede representar en la siguiente reacción de equilibrio:
({{H}_{2}}O+{{H}_{2}}Oleftrightarrow {{H}_{3}}{{O}^{+}}+O{{H}^{-}})
Es notorio en la ecuación, que una molécula de agua dona un protón, actuando como ácido, a otra molécula de agua que actúa como base. Este fenómeno se entiende como la autoionización o autoprotólisis del agua. Esta reacción representa un concepto de ácido y base, específicamente, el concepto de Brönsted y Lowy. La flecha en ambos sentidos, indica que el agua se encuentra en equilibrio con los iones hidronio e iones hidroxilo. Sin embargo, este equilibrio está muy desplazado a la izquierda. Quiere decir, que pocas moléculas de agua participan en la transferencia de protones, por ende la concentración de protones en pequeña.
Reconociendo la autoionización del agua podemos darnos cuenta que, el agua pura tiene un valor de pH, ya que tiene una concentración de iones hidrógeno. Como vimos anteriormente, esta concentración es de 1×10-7 mol/L, eso indica que tiene un pH igual a 7.
¿Qué es el pOH?
En algunas ocasiones es útil hablar del pOH. Así como la acidez se mide en términos del pH, la basicidad o alcalinidad se valora en términos del pOH. De manera análoga el pOH se define como el logaritmo negativo de la concentración de los iones hidroxilo.
(pOH=-logleft[ O{{H}^{-}} right])
Recuerda que los valores de iones hidronio e hidroxilo están relacionados, igualmente el pH y el pOH lo están, de modo que la suma de ambos es igual a 14. En consecuencia podemos escribir:
(pH+pOH=14)
Esta igualdad permite calcular el pOH de una solución conociendo su pH y viceversa. En procesos prácticos esto quiere decir que, añadir un ácido en una solución produce un descenso en el pH pero eleva el pOH y, por el contrario, adicionar una base conlleva al descenso del pOH pero aumenta el pH.
pH en el cuerpo humano
El nivel de acidez de nuestra sangre se puede determinar a través de una escala de pH que va desde el nivel 0 al 14, siendo el nivel 7 el valor neutro. Hay un exceso de acidez cuando aparecen valores entre 7 y 7,35 pH. Cuando esto ocurre el organismo reacciona negativamente con algunos síntomas: fatiga y falta de energía, infecciones, sequedad en la piel, falta de minerales y disfunción renal.
Si el organismo es excesivamente alcalino también hay un desequilibrio que puede afectar a las funciones metabólicas o provocar una hiperventilación (la alcalilosis presenta unos valores comprendidos entre 7,45 y 7,8 pH).
En cualquier caso, para mantener un buen estado de salud es recomendable que el pH sea más alcalino que ácido (los procesos celulares son más eficientes en ambientes alcalinos).
Composición hacia el equilibrio del pH
Para tener un buen estado de salud el organismo debe mantener un equilibrio de pH adecuado, ya que por encima o por debajo de los valores correctos se produce una enfermedad porque las células no realizan sus funciones vitales de manera correcta.
El rango de pH en el cuerpo es saludable cuando oscila entre 7,35 y 7,45. En este sentido, desde un punto de vista médico es un error intentar alcalinizar el organismo siguiendo dietas con productos exclusivamente alcalinos.
Recordar que los procesos de homeostasis del organismo buscan siempre el equilibrio en todos los sentidos (la concentración de oxígeno, la temperatura, la cantidad de minerales o el pH).
Un aspecto importante en el equilibrio del pH es la correcta ingesta de minerales (los minerales son los micronutrientes que se ocupan del correcto funcionamiento de las reacciones bioquímicas).
La importancia de los alimentos para regular el pH
Toda comida o bebida que consumimos puede ser ácida, alcalina o bien encontrarse en un nivel intermedio entre ambas. Los mecanismos homeostáticos de nuestro cuerpo no permiten que el pH se desequilibre en exceso. Se produce un cierto desequilibrio cuando ingerimos alimentos demasiado ácidos o demasiado alcalinos.
Como pauta general, tenemos un consumo más elevado de productos acidificantes, como el café, la leche, la comida procesada, el alcohol, el azúcar o la proteína animal. Para lograr un pH saludable es conveniente ingerir productos alcalinizantes, como las frutas, las verduras y las hortalizas.
Observar, por otro lado, que una comida acidificante no implica que sea insana. En este sentido, la dieta sana debe incorporar alimentos ácidos y alcalinos de manera equilibrada.
Bibliografía
Irazábal A. y de Irazábal C. Química. Ediciones Co-Bo. Caracas, 1995.
Mendoza L. Química General. INTEC. Santo Domingo, 2002.
Siga en pH (escala de acidez) (parte 2)

Trabajo publicado en: Jun., 2019.
Ilustraciones: robin_ph
Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.