Definición de Enlace Iónico

M.C. en Ingeniería y Física Biomédicas
Un enlace químico es una interacción entre átomos, los cuales, comparten electrones, los enlaces químicos se dividen en iónicos, covalentes y metálicos. Un enlace iónico es aquella unión química que surge de la interacción entre dos especies denominadas “iones”. A su vez, los iones, son átomos con cargas asociadas debido a que carecen o exceden el número de electrones de su última capa de valencia en comparación con el átomo del elemento en su forma estable. Los enlaces iónicos, por lo general, se dan entre metales pertenecientes a los grupos 1 y 2 de la tabla periódica y no metales de los grupos 16 y 17.
Formación y estructura de los enlaces iónicos
Existen tres conceptos básicos a establecer para llegar a comprender, de manera acertada, cómo se forma un enlace iónico estos son: electrones de valencia, la regla del octeto y transferencia de electrones. Los electrones de valencia son aquellos que se encuentran en la última capa o nivel de energía, según la configuración electrónica de cada elemento, es decir, son los electrones que se encuentran más alejados del núcleo del átomo. Por lo tanto, es posible que el elemento comparta, “done” o reciba dichos electrones para acceder a una configuración más estable. Aquí entra el siguiente concepto, la regla del octeto. Se sabe que los gases ideales, que se encuentran en el grupo 18 de la tabla periódica, son elementos altamente estables que no interactúan con ningún otro elemento y, para arrancar un electrón de su última capa, se requieren energías extremadamente altas. Esto se asocia al número de electrones que se encuentran en este último nivel energético (a excepción del Helio), todos los gases ideales contienen 8 electrones en este nivel. Debido a esto, la regla del octeto establece que “los átomos pueden ganar, perder o compartir electrones de valencia, hasta que su número llega a ocho”.
Cuanto más cerca se encuentren los elementos de cumplir la regla del octeto su “afinidad electrónica” aumenta, esto se refiere a la capacidad de un átomo para atraer electrones, estos elementos tienden a recibir electrones de otros elementos que, por el contrario, se encuentran muy lejos del octeto. De estos últimos se espera que “donen” sus electrones, esto se conoce como transferencia de electrones. Por ejemplo, los halógenos, que se ubican en el grupo 17 de la tabla periódica, tienen 7 electrones en su último nivel, esto los hace excelentes receptores de electrones, por el contrario, los metales alcalinos del grupo 1 de la tabla periódica, tienden a donar su único electrón de valencia muy fácilmente.
Cuando un elemento pierde un electrón adquiere una carga positiva, en contraparte, cuando un elemento recibe un electrón, este queda con una carga negativa, en pocas palabras esto explica cómo se forman los iones. Un ion con carga positiva es llamado catión, mientras que un ion con carga negativa es un anión, estos dos tipos de iones, con cargas de signo opuesto se atraen formando, finalmente, un enlace iónico.
La ecuación en la siguiente imagen, explica la formación de un enlace iónico, para dar lugar a la formación de uno de los compuestos iónicos más conocidos, el cloruro de sodio (NaCl), comúnmente llamado sal de mesa. Este compuesto se forma gracias a la transferencia del único electrón de valencia del sodio (Na) a un átomo de cloro (Cl), el cual completará su octeto gracias a este enlace.
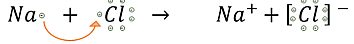
Compuestos
Los enlaces iónicos tienden a formar compuestos estructuralmente cristalinos, quebradizos y con altos puntos de ebullición, a nivel molecular, se puede ver cómo los iones de Na+ y Cl– se encuentran empacados en cubos de dimensiones pequeñísimas. Este nivel de empaquetamiento se debe a la gran cantidad de energía que mantiene unidos a los elementos que participan en el enlace. De la misma manera, la fuerza de atracción en los enlaces iónicos es lo que provoca que los compuestos sean sólidos y muy rígidos, incluso a temperaturas muy altas, por ejemplo, la sal de mesa funde a 801°C. Lo anterior está relacionado directamente con la fuerza del enlace, que en otros términos se refiere a la energía necesaria para separar a los iones enlazados. Un ejemplo de esto se puede ver al formar una solución salina en agua, a mayor agitación y temperatura se agreguen al sistema, se observa que los cristales de sal “desaparecen”, lo que ocurre realmente es una disociación de las redes cristalinas en dónde los cationes Na+ interaccionan con la carga parcial negativa de la molécula de agua, mientras que los aniones Cl-, son atraídos por la carga parcial positiva. La fuerza de un enlace iónico crecerá, cuanto mayor sea la diferencia de cargas entre el anión y el catión, además, en este escenario, el empaquetamiento del cristal también incrementará, y, por tanto, mayor será la energía necesaria para romper dicho enlace.
Otros compuestos formados a partir de enlaces iónicos son: el bromuro de potasio (KBr), medicamento anticonvulsivo de uso veterinario , el cloruro de potasio (KCl), conocido sustituto para la sal de mesa, el fluoruro de litio (LiF), usado para medir dosis de radiaciones ionizantes y el fluoruro de sodio (NaF), utilizado en la práctica clínica como un agente anticaries.

Trabajo publicado en: Ene., 2024.
Referencias
Brown, T., LeMay, E., Bursten, B., Escalona y García, H. J., Escalona, M. C. R., & Doria Serrano, M. d. C. (1998). Quimica: La ciencia central (7a. ed.--.). México D.F.: Prentice Hall.Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.