Significado de ley de Boyle-Mariotte Definición, fórmula, gas ideal, y ejercicio

Licenciada en Física
Definición formal
La ley de Boyle-Mariotte rige el comportamiento de los gases ideales al establecer la relación que hay entre dos de sus propiedades más significativas: la presión y el volumen.
Ocurre que, a medida que aumenta la presión en una muestra de gas, el volumen de la misma disminuye, y viceversa. Cuando la presión disminuye, el gas se expande. Es importante destacar que esto sucede siempre y cuando la masa y la temperatura de la muestra se mantengan constantes, a lo que se denomina, por su parte, como proceso isotérmico.
La relación entre la presión P y el volumen V de la muestra, es de proporcionalidad inversa, o alternativamente, se puede expresar diciendo que la presión es inversamente proporcional al volumen:
\(P\propto \frac{1}{V}\)
Dos magnitudes son inversamente proporcionales cuando su producto es constante, de manera que la relación entre P y V también se expresa mediante el siguiente enunciado matemático:
\(P\cdot V=constante\)
Esta ley es empírica, lo cual quiere decir que se deduce a partir de la experimentación, y su gráfica corresponde a una hipérbola. En la siguiente figura se muestra, a modo de ejemplo, la gráfica de la curva P∙V = 10.
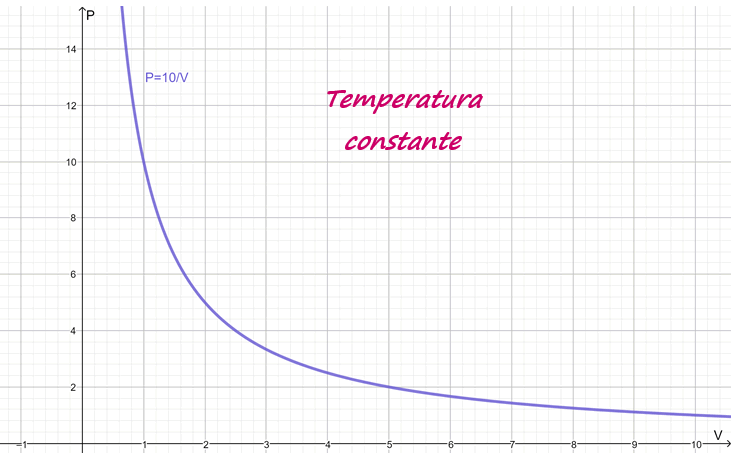
Es razonable suponer que si se comprime un gas en un recipiente, por ejemplo con la ayuda de un pistón, la presión aumente. Después de todo, la presión es el efecto global de las innumerables colisiones de las moléculas contra las paredes del recipiente contenedor, y la cantidad de colisiones por unidad de tiempo aumenta cuando la densidad del gas, que resulta del cociente masa/volumen, se eleva.
En cambio, al aumentar el volumen, la presión disminuye, ya que las partículas tienen más espacio para moverse y la probabilidad de colisionar con las paredes del recipiente disminuyen.
Robert Boyle y Edmé Mariotte
Robert Boyle (1627-1691) y Edmé Mariotte (1620-1684) encontraron la primera de las leyes de los gases. Boyle era un irlandés proveniente de una familia noble, que trabajó en la Universidad de Oxford al lado de Robert Hooke, el gran rival de Isaac Newton. Por su parte Edmé Mariotte, nacido en Francia, combinó la vocación religiosa con la científica, pues además de físico y químico, fue abad de un monasterio.
Ambos científicos, luego de llevar a cabo cuidadosos experimentos con muestras de aire, llegaron de manera independiente a la conclusión de que el producto P∙V es una constante, si la temperatura y la masa del gas permanecen inalteradas.
El modelo de gas ideal
La ley de Boyle-Mariotte es válida para los llamados gases ideales, un modelo teórico que simplifica en gran medida el comportamiento de un gas cualquiera, al suponer que:
– Las moléculas del gas son tan pequeñas que no es necesario tener en cuenta su tamaño, sobre todo considerando que este es muchísimo menor que las longitudes recorridas por ellas.
– Además, las moléculas apenas interactúan, excepto muy brevemente al chocar, y cuando lo hacen, el choque es elástico, por lo que se conservan tanto el impulso o cantidad de movimiento, como la energía cinética.
– Y finalmente se supone que esta energía cinética y la temperatura de la muestra gaseosa son proporcionales, es decir, a mayor agitación de las partículas, mayor será la temperatura.
Los gases ligeros, sin importar su identidad, siguen muy de cerca estas pautas cuando se encuentran en condiciones estándar de temperatura y presión, esto es: a 0ºC y a presión atmosférica (1 atmósfera). Para estos gases, la ley de Boyle-Mariotte describe muy acertadamente su comportamiento.
Puesto que P∙V es constante a una temperatura dada, si se modifica la presión del gas, el volumen lo hace de forma tal que el producto se mantiene sin cambios, por lo tanto, en dos estados diferentes, el 1 y el 2, es posible plantear la siguiente igualdad:
P1∙V1 = P2∙V2
Entonces, conociendo uno de los estados, más una de las variables del otro, se puede saber la variable que falta, al despejarla de la ley de Boyle-Mariotte.
Ejercicio de aplicación
A una presión de 1.2 atm, una muestra de aire tiene un volumen de 3.8 L. Si se aumenta la presión hasta 6.6 atm, manteniendo constante la temperatura, ¿cuál será el volumen de la muestra?
Respuesta
De acuerdo a la ley de Boyle-Mariotte, si la temperatura es constante, el volumen debe disminuir al aumentar la presión, según la ecuación:
P1∙V1 = P2∙V2
Para el estado inicial se tiene que P1 = 1.2 atm y V1 = 3.8 L, mientras que en el estado final la presión es P2 = 6.6 atm y se desconoce el valor de V2, el cual se despeja como sigue:
\({{V}_{2}}=\frac{{{{P}_{1}}\cdot {{V}_{1}}}}{{{{P}_{2}}}}=\frac{{1.2atm\times 3.8L}}{{6.6atm}}=0.69L\)
El volumen de la muestra de aire disminuyó hasta 0.69 L.

Trabajo publicado en: Feb., 2021.