Definición de Molécula

Ingeniera Química
1. Una molécula es un conjunto de, como mínimo, dos átomos, que representa la menor unidad capaz de retener las propiedades químicas y físicas de una sustancia.
Etimología: Por el francés molécule, con referencia en el latín científico molecula, sobre el latín moles, de ‘masa’, y el sufijo -cula, como propiedad diminutiva.
Cat. gramatical: Sustantivo fem.
En sílabas: mo-lé-cu-la.
Molécula
Una molécula es un conjunto de dos o más átomos sin carga, unidos entre sí mediante enlaces covalentes. Así mismo, representa una estructura definida y es la porción más pequeña que constituye a toda sustancia pura y que posee todas sus propiedades. Dado que una molécula se conforma por medio de enlaces covalentes, muchas veces a los compuestos formados se los denomina compuestos moleculares o compuestos covalentes en similitud de significado.
En un compuesto covalente no existe suficiente diferencia de electronegatividad entre los átomos unidos como par que exista una transferencia neta de electrones entre ellos. Por ende, los electrones de enlace se comparten y así es que se forma la molécula. Por ejemplo, cuando dos átomos de hidrógeno se acercan, los núcleos de ellos con cargaS positivas y los electrones con cargas negativas se repelen mutuamente. Sin embargo, existe una atracción entre núcleos y electrones. Básicamente, por una cuestión lógica y de física de la naturaleza, la fuerza de atracción entre núcleo y electrón debe ser mayor que las fuerzas de repulsión entre cargas positivas o cargas negativas y, de esta manera, se forma una molécula. Se sabe que las atracciones entre núcleos y electrones hacen que las densidades electrónicas se concentren en los núcleos y, por ende, las interacciones electrostáticas resultantes son atractivas.
Estructura de Lewis
La manera más clásica y aceptada universalmente para representar las moléculas es la Estructura de Lewis. Lewis fue un científico que comprendió la forma en que las moléculas se atraen unas con otras y pudo plasmarlo de manera simplificada para su fácil entendimiento.
Cuando se forman enlaces covalentes y los electrones se comparten entre los átomos, se busca la estabilización energética de las especies por lo que, siguiendo la Regla del Octeto, el átomo busca lograr la configuración electrónica externa del gas noble más cercano. En esta estructura, un enlace covalente se representa por uno o más pares de electrones compartidos, de forma que si se comparte un único par de electrones el enlace será simple, si se comparten dos pares será doble y así sucesivamente. Por ejemplo, una molécula de metano está formada por cuatro enlaces simples, el cual se puede representar de forma simplificada con una línea:
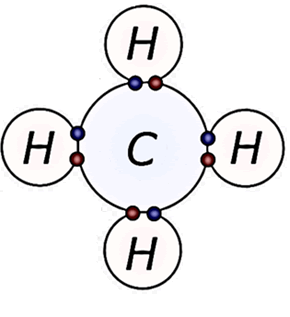
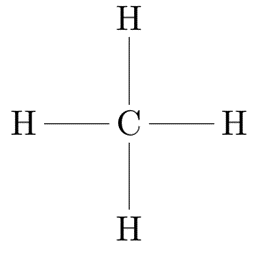
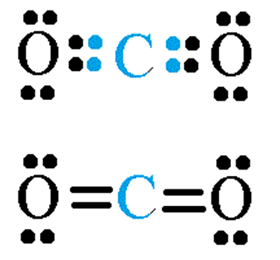
Sin embargo, la molécula de dióxido de carbono está formado por dos enlaces covalentes dobles entre cada oxígeno y el carbono central, dado que, de esta manera, todas las especies completan ocho electrones en su último nivel:
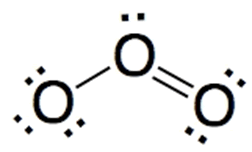
También existen casos en donde en una misma molécula conviven enlaces covalentes dobles y simples, como por ejemplo la molécula de ozono:
Así mismo, se tienen casos de moléculas con enlaces covalentes triples como el nitrógeno molecular:

Se sabe que, a medida que aumentan la cantidad de electrones compartidos, la energía de ese enlace aumenta y, por lo tanto, es más corto. Esto implica la existencia de tablas en donde se tabulan las longitudes de enlace entre distintos átomos dependiendo si este es simple, doble o triple. En todos los casos, se observa una misma tendencia, disminución de la longitud a medida que se incrementa la cantidad de electrones enlazados.
Resonancia
Algunas moléculas o iones no se representan con una única estructura, por ejemplo, retomando el caso de la molécula de ozono, se tiene otra alternativa en su representación:
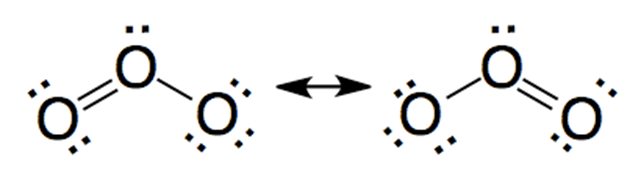
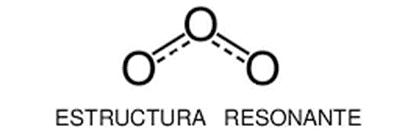
A lo anterior, se lo denomina resonancia. La resonancia es un fenómeno mediante el cual coexisten distintas estructuras en una misma molécula. Ninguna de ellas es la estructura real, sin embargo, la combinación de todas las posibles estructuras se asemeja a la realidad observada. Según vimos anteriormente, la longitud del enlace doble debería ser menor que la longitud del enlace simple. Cuando esto es observado mediante la aparatología adecuada, no se observa claramente. Si no que el enlace doble “interactúa” por igual con los dos oxígenos de los extremos, encontrando que las longitudes de enlace O-O son iguales en ambos casos. Muchas veces, esta posibilidad de “movimiento” del enlace doble o triple es representada a través de una línea punteada, como por ejemplo:
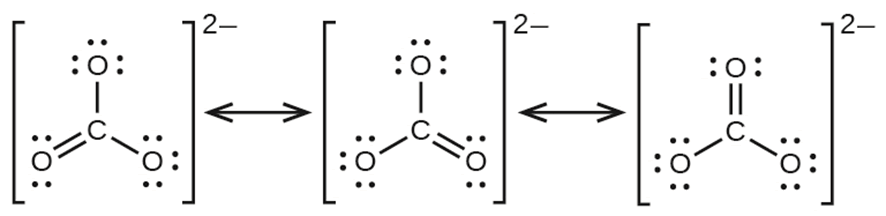
Existen otros casos similares, como por ejemplo el ión carbonato. En muchas ocasiones, encontraremos las posibles estructuras resonantes dibujadas dentro de corchetes con una flecha entre ellas, indicando las distintas posibilidades de ubicación del doble enlace:

Art. actualizado: Agosto 2022; sobre el original de diciembre, 2009.
Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.