Definición de Velocidad de Reacción

M.C. en Ingeniería y Física Biomédicas
1. Determinación del intervalo de tiempo para que una reacción química evolucione, es decir, qué tan rápido se utilizarán los reactivos para la formación de los productos. Sus estudios se desarrollan a instancias de la cinética química.
Cat. gramatical: Sustantivo fem.
En sílabas: ve-lo-ci-dad + de + re-ac-ción.
Velocidad de Reacción
Una ecuación química que describe una reacción, generalmente nos da idea de las sustancias que se convierten en otras sustancias con características muy diferentes, también, nos permite darnos una idea de las cantidades y proporciones necesarias para que estas sustancias reaccionen. Sin embargo, para terminar de caracterizar una reacción hace falta cierta información importante, como cuál es la sucesión de los eventos que culminan en la reacción o el tiempo en el que transcurren todos ellos y bajo qué condiciones específicas.
La velocidad de reacción química se define, precisamente, como la rapidez a la que ocurre una reacción, y nos da idea del tiempo en el que puede ocurrir una reacción. En otros términos, se puede expresar como la concentración de un producto que se forma por unidad de tiempo o la concentración de un reactivo que se consume por unidad de tiempo. Asimismo, se define como cantidad de producto formado o reactivos consumidos, por unidad de tiempo. Para ejemplificar estas velocidades de cambio en una reacción, se empleará la siguiente ecuación química en su forma balanceada:
A + 3B ⟶ 2F
A partir de esta formulación, es posible expresar la velocidad de reacción a través de diferentes formas, respecto al producto: d[F]/dt, o bien, df/dt, y respecto a los reactivos: -d[A]/dt, -d[B]/dt, o bien, -da/dt, -db/dt. Es necesario aclarar que la notación [A], [B], [F], hace referencia a las concentraciones, es decir, cantidad por unidad de volumen, mientras que los diferenciales de A, B, F, sin los corchetes, se refieren a las cantidades de los reactivos y producto, respectivamente. Cualquiera de estas seis expresiones nos servirá para describir la velocidad de reacción.
Algunas reacciones químicas solo requieren de fracciones de segundo para completarse, mientras otras pueden tardar años. Así, las velocidades de reacción abarcan rangos enormes en escalas de tiempo, por ejemplo, la absorción de luz por una molécula se completa en femtosegundos, la explosión de dinamita ocurre en segundos, mientras que las reacciones que dan lugar a la erosión en las rocas pueden tardar millones de años. El estudio de las velocidades de reacción dentro de la química se conoce como cinética química y se encarga de observar miles de tipos diferentes de reacción, desde las referentes a la capa de ozono hasta como un activo farmacológico actúa en el cuerpo.
Factores que influyen en las velocidades de reacción
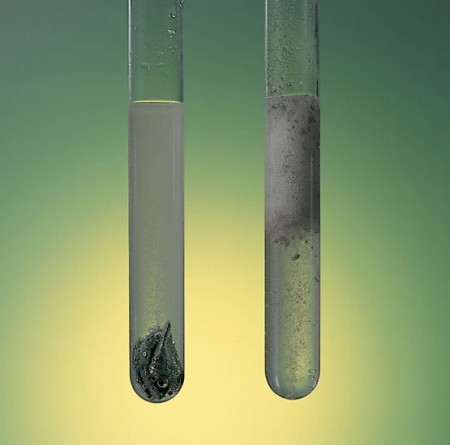 En muchas ocasiones resulta útil modificar la velocidad de una reacción, para que esta ocurra en tiempos menores, o mayores, según lo requerido en ciertos procesos. Para esto, es necesario establecer los factores que moldean la velocidad, más allá de la naturaleza de las sustancias que participan. Esencialmente, se definen cuatro de estos factores: Estado físico de los reactivos, concentraciones de los reactivos, temperatura y la presencia de un catalizador.
En muchas ocasiones resulta útil modificar la velocidad de una reacción, para que esta ocurra en tiempos menores, o mayores, según lo requerido en ciertos procesos. Para esto, es necesario establecer los factores que moldean la velocidad, más allá de la naturaleza de las sustancias que participan. Esencialmente, se definen cuatro de estos factores: Estado físico de los reactivos, concentraciones de los reactivos, temperatura y la presencia de un catalizador.
El estado físico de los reactivos se refiere a si estos se encuentran en estado sólido, líquido o gaseoso. Por lo general, las reacciones ocurren en medios homogéneos, es decir, los reactivos participantes se encuentran en el mismo estado, frecuentemente gaseoso o líquido. En el caso de las reacciones que se dan en medios heterogéneos, con las sustancias en diferentes fases, la reacción se puede ver limitada por el área de contacto entre los reactivos. Un ejemplo son los medicamentos en forma de polvo que entran al torrente sanguíneo más rápido que uno activo en forma de tableta, pues este contará con un área de contacto menor. Las concentraciones de los reactivos limitan la velocidad de reacción a medida que disminuyen, es decir, a menor concentración de un reactivo, menor es la probabilidad de que las moléculas de este se encuentren y colisionen con las de otro reactivo. Una mayor concentración generará más colisiones y por lo tanto la velocidad de reacción aumentará.
En cuanto a la temperatura de reacción, el aumento de la velocidad de reacción es proporcional al aumento de la temperatura. Un incremento de temperatura significa un aumento en la energía cinética de las moléculas, con lo que estas colisionarán más rápido y con mayor frecuencia. Por ejemplo, la leche se descompone más rápido a temperatura ambiente que si estuviera en refrigeración, el motivo de esto es que, a mayor temperatura, las reacciones bacterianas aumentaran su velocidad acelerando la descomposición. Por último, un catalizador es un agente que aumenta la velocidad de reacción sin consumirse, es decir, no participa en la reacción en sí, solo es un mediador para que esta ocurra en un menor tiempo. Estos agentes promueven diferentes tipos de colisiones alterando el mecanismo de reacción y pueden ser de origen inorgánico, como algunos metales, o moléculas orgánicas. En los organismos biológicos, por ejemplo, las enzimas fungen como los principales catalizadores en reacciones fisiológicas.

Art. actualizado: Oct. 2023; sobre el original de febrero, 2014.
Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.