Definición de Sustancia

Licenciada en Química
1. La materia, independientemente de su estado, cuya composición y propiedades se conservan en el caso de analizar partes de la misma.
2. Elemento o concepto abstracto de mayor importancia en la estructura o funcionamiento de algo.
3. Lo que torna único y real a cada ser vivo u objeto.
4. Nutrientes que poseen los alimentos que posibilitan el desarrollo y mantenimiento de los organismos.
5. Esencia que existe en Dios y entidades divinas.
6. Conjunto de conceptos y valoraciones en función del conocimiento y el pensamiento, capaz de expresarse por una persona.
Etimología: Por el latín substantia, formado por el prefijo sub-, que remite a ‘debajo’, ‘detrás’, ‘hacia’, el verbo stāre, en cuanto ‘estar’, y el sufijo -ia, a efectos de la sustantivación.
Cat. gramatical: Sustantivo fem.
En sílabas: sus-tan-cia.
Sustancia Química
 Una sustancia química es cualquier parte de la materia, de modo que individual o conjuntamente como un todo, se manifiesta la misma composición y propiedades, aun cuando se somete a un proceso físico. De este modo, se incluyen todos los elementos (por ejemplo, cobre, oro, aluminio, oxígeno) y compuestos químicos, tales como: óxidos metálicos, agua, cloruro de sodio, dióxido de carbono, etc., cuya composición y propiedades (físicas o químicas) son uniformes en cualquier porción de materia, pueden estar en cualquier estado físico: sólido, líquido o gaseoso, y además, su composición permanece inalterada cuando se somete a un cambio de fase [1,2]. Más adelante se explica en detalle las propiedades de los elementos y compuestos químicos.
Una sustancia química es cualquier parte de la materia, de modo que individual o conjuntamente como un todo, se manifiesta la misma composición y propiedades, aun cuando se somete a un proceso físico. De este modo, se incluyen todos los elementos (por ejemplo, cobre, oro, aluminio, oxígeno) y compuestos químicos, tales como: óxidos metálicos, agua, cloruro de sodio, dióxido de carbono, etc., cuya composición y propiedades (físicas o químicas) son uniformes en cualquier porción de materia, pueden estar en cualquier estado físico: sólido, líquido o gaseoso, y además, su composición permanece inalterada cuando se somete a un cambio de fase [1,2]. Más adelante se explica en detalle las propiedades de los elementos y compuestos químicos.
Por el contrario, si una porción de la materia se divide en elementos o compuestos químicos cuando es sometida a un proceso físico, tales como: destilación, evaporación, filtración, entre otros, entonces corresponde a una mezcla, cuya composición no es contante y las sustancias que la conforman conservan sus propiedades. Estas mezclas pueden ser homogéneas cuya composición es uniforme, como el aire o el agua de mar; o heterogéneas, como la arena en agua.
Tipos de sustancias químicas
Cuando una sustancia es sometida a un proceso químico y este se descompone en sus elementos constituyentes, la materia se puede clasificar como compuesto químico, sin embargo, cuando no ocurre tal descomposición, entonces se clasifica como elemento químico, conformado por átomos que no pueden crearse ni destruirse durante una transformación química ordinaria [2].
Tomando en cuenta el ejemplo de la figura 1, los átomos de sodio (Na), cloro (Cl), hidrógeno (H) y oxígeno (O) se unen de manera individual para conformar los elementos, esto es posible a través de enlaces covalentes y enlaces metálicos (en el caso del sodio) que dan lugar a la conformación de moléculas en su forma natural, como H2, O2, Cl2 (todas en estado gaseoso) y Na metálico (estado sólido). Cuando estos elementos se combinan en una reacción química, ocurre una ruptura de enlaces químicos de los elementos y la formación de nuevas moléculas enlaces que involucran átomos diferentes en proporciones estequiométricas definidas que corresponden a los compuestos químicos, como el agua (H2O), cloruro de hidrógeno (HCl), cloruro de sodio (NaCl) y clorato de sodio (NaClO3).
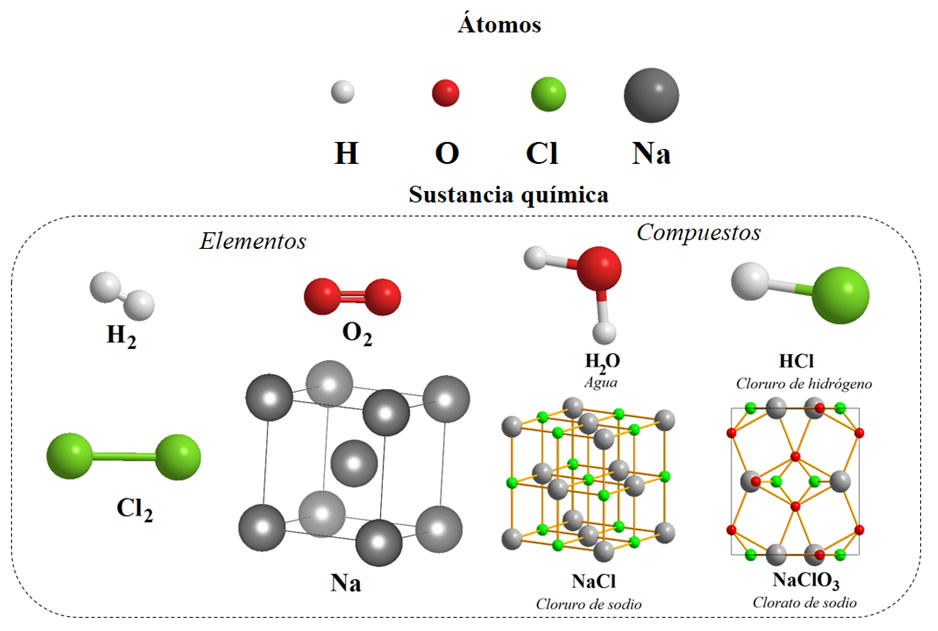
Figura 1. Los átomos corresponden a la unidad más pequeña que compone la materia. Los átomos del mismo tipo unidos por enlaces químicos forman los elementos y la combinación de los elementos en proporciones definidas da lugar a la formación de compuestos químicos.
Elemento químico
La teoría de Dalton planteada entre 1803 y 1808 sobre la naturaleza de la materia indica que los elementos están compuestos por átomos, siendo estos las unidades más pequeñas, que a su vez, está conformada por neutrones (partículas subatómicas de masa 1,00826 uma y carga neutra), por electrones (partículas subatómicas de masa 0,00524 uma y carga -1) y protones (partículas subatómicas de masa 1,00782 uma y carga +1). A la actualidad se han descubierto 118 elementos, de ellos, solo 83 se encuentran en la naturaleza; los elementos restantes han sido sintetizados a escala de laboratorio con experimentos de radiactividad [1].
Un elemento químico se diferencia con respecto a otro por la cantidad de protones que este posee en el núcleo del átomo, lo que corresponde al número atómico (Z) en la tabla periódica. Esta diferencia tiene como consecuencia que los elementos tengan distintas cantidades de electrones para conservar el elemento de forma neutra, por lo tanto, sus configuraciones electrónicas ubican al elemento en un período y grupo particular de la tabla periódica, además que elementos de átomos distintos tengan masas atómicas distintas, por ejemplo: la masa atómica promedio del nitrógeno (Z=7) es de 14, 007 uma mientras que para el oxígeno que tiene un protón y un neutrón adicional en el núcleo (Z=8) es de 15,999 uma.
Compuesto químico
Los compuestos químicos se definen como aquellas sustancias formadas por la combinación de átomos de diferentes elementos. De acuerdo a la naturaleza de los enlaces químicos que conforman los compuestos, estos pueden ser moleculares o iónicos.
En los compuestos moleculares, la unidad más pequeña posible en la que se mantienen las mismas proporciones de los átomos constituyentes se denomina molécula. El agua, el amoniaco, la sacarosa, el cloruro de hidrógeno, entre muchos otros, son ejemplos de compuestos moleculares; todos ellos se caracterizan por estar formados por dos o más elementos: el agua está conformada por dos átomos de hidrógeno (H) y un átomo de oxígeno (O), el amoniaco por un átomo de nitrógeno (N) y tres átomos de hidrógeno (H), la sacarosa por doce átomos de carbono (C), veintidós átomos de hidrógeno (H) y once átomos de oxígeno (O). Todas estas combinaciones tienen lugar en proporciones numéricas sencillas, siguiendo la teoría atómica de Dalton. Por esta razón, los compuestos químicos pueden ser representados por fórmulas químicas que se obtienen a partir de los elementos constituyentes y que determinan la proporción en masa de los elementos en un compuesto (Ley de proporciones múltiples) [1].
En el caso de los compuestos iónicos están formados por iones con cargas opuestas atraídas por interacciones electrostáticas, tal como cloruro de sodio (NaCl) y clorato de sodio (NaClO3) mostrados en la figura 1. Se forman entre iones de alta y baja electronegatividad, adicional a esto, se representan a través de fórmulas empíricas que no representan moléculas discretas, sino que representan la proporción numérica entre iones, por ejemplo, en el cloruro de sodio hay un ion de Na+ por cada ion Cl–.

Art. actualizado: Agosto 2022; sobre el original de septiembre, 2010.
Referencias
[1] R. Chang, Química, Décima, McGraw-Hill/Interamericana Editores, México, 2010.[2] R. Petrucci, G. Herring, J. Madura, C. Bissonnette, Química General, Décima, Pearson Education S.A., Madrid, 2011.
Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.