Significado de sustancias puras Definición, ejemplos, y diferencia simples y compuestas

MSc. Licenciada en Química
1. Materia que conserva sus propiedades y composición, independientemente de la porción que se tome para analizarla, de modo que se la puede determinar como tal a partir de que: a) Tiene una composición química constante, lo cual se denomina homogénea; b) Sus propiedades son fijas; c) No podrá ser separada en distintas sustancias más simples bajo ningún método físico.
2- Cuerpo cuya composición permite diferenciar entre dos tipos de sustancias puras, simples (en presencia de apenas un elemento químico), y compuestas (en presencia de al menos dos elementos químicos).
Etimología: Sustancia, por el latín substantia. + Pura, en el latín purus..
Cat. gramatical: Sustantivo fem.
En sílabas: sus-tan-cia + pu-ra.
Sustancias Puras
Definición formal
Las sustancias puras son el material sobre el que se reconoce que todas las partículas, átomos, moléculas y/o elementos que lo componen, son exactamente iguales en toda la extensión de su masa.
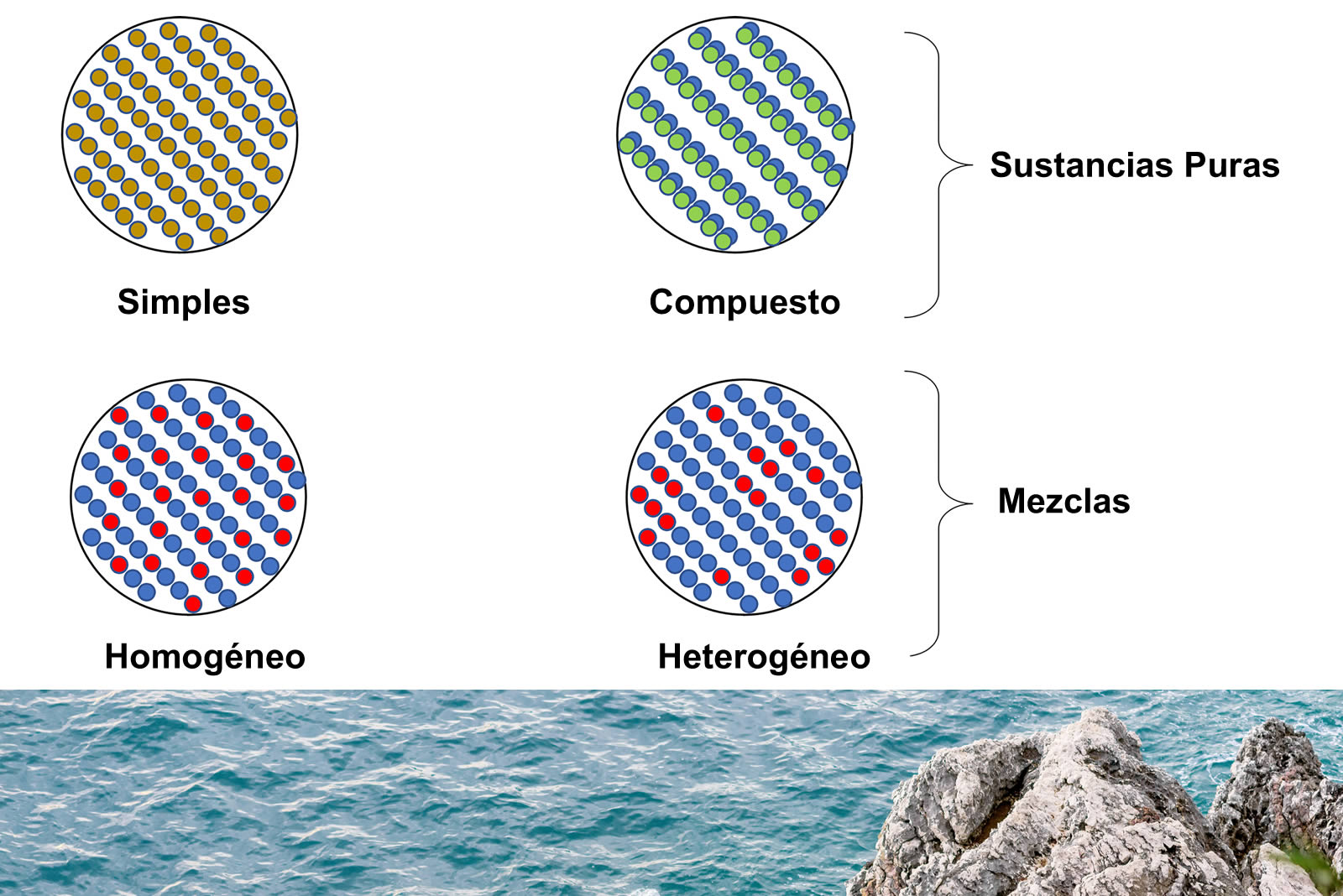
Las sustancias puras mantienen su composición y sus propiedades características, inclusive cuando cambian de estado físico. Las sustancias puras pueden ser identificadas como simples o compuestas, observando que la diferencia recae en que esta última puede separarse en sus elementos.
Elementos y ejemplos de las sustancias simples
Toda la materia está constituida por sustancias simples o elementos. Los elementos se asocian en proporciones fijas y específicas, para formar compuestos (ya hablaremos de los compuestos más adelante). Podemos reconocer a los elementos porque éstos no se descomponen en sustancias más sencillas.
Los elementos se pueden diferenciar de acuerdo a cualidades que, entre otras cosas, permiten ordenarlos en grupos, familias y periodos dentro de una tabla. Esta tabla es reconocida como La Tabla Periódica de los Elementos Químicos. A saber, los grupos son las columnas verticales que, en la mayoría de las tablas, se enumeran con números romanos del I al VIII, los periodos son las filas horizontales numeradas del 1 al 7 y las familias son dos series dentro de los grupos, llamadas serie A y serie B, hay ocho grupos en la familia A y ocho en la B.
Estas sustancias simples, agrupadas en la tabla periódica, se distinguen como metales, no metales y metaloides. Veamos cada uno de ellos:
Los metales son sustancias identificadas como tal, porque todos son sólidos a temperatura ambiente (excepto el mercurio que es líquido cuyo punto de fusión es de -39ºC). Además casi todos los metales tienen puntos de fusión elevados, se pueden moldear y se corroen con facilitad, como por ejemplo el hierro (Fe). Estos elementos están ubicados del lado izquierdo de la tabla periódica y se dividen en metales alcalinos, alcalinotérreos y metales de transición.
El grupo de los no metales también presenta algunas particulares. Todos tienen punto de fusión inferior a los metales, son opacos, no se pueden moldear porque son quebradizos y no conducen el calor ni la electricidad. En este grupo se incluyen elementos como el carbono (C), el selenio (Se), el oxígeno (O), el fósforo (P), el azufre (S), etc. A diferencia de los metales, estos elementos existen en los tres estados de la materia. Por ejemplo, el cloro (Cl) es gaseoso, el bromo (Br) es líquido y el azufre (S) es sólido.
Los metaloides se llaman así porque tienen propiedades intermedias entre los metales y los no metales. Es decir, comparten algunas características con los metales y otras con los no metales. Este grupo es el minoritario en la tabla periódica. Algunos son el silicio (Si), el boro (B), el germanio (Ge) y otros.
Sustancias compuestas: ¿Cómo se forman y separan?
Mediante la interacción de dos o más sustancias simples, se originan sustancias compuestas o simplemente, compuestos. Los elementos dentro de las sustancias compuestas, se mantienen unidos entre sí a través de una fuerza llamada enlace químico.
Así mismo, no debe confundirse los compuestos con las mezclas, las cuales están formadas por diferentes sustancias, no obstante, las mezclas mantienen su identidad y naturaleza y se pueden separar mediante métodos físicos. Los compuestos se forman por uniones químicas (los enlaces químicos) mientras que las mezclas se forman por uniones físicas entre sus constituyentes.
Para la descomposición de las sustancias compuestas, se deben romper enlaces químicos y por ello, se usan métodos basados en la aplicación de energía. Existe la descomposición térmica que, como su nombre lo indica, consiste en aplicar calor al compuesto.
Otro método de separación es la descomposición eléctrica o electrólisis, en la que se hace pasar una corriente eléctrica a través de una sustancia pura, hasta lograr su separación. Un ejemplo de esto es la electrólisis del agua, para formar los gases oxígeno e hidrógeno. En este modelo se muestra que el agua es una sustancia compuesta formada por los elementos oxígeno e hidrógeno.
Diferencia entre compuestos inorgánicos y orgánicos
Compuestos inorgánicos
Son representativos de los compuestos inorgánicos: Los óxidos, que provienen de la combinación del oxígeno con un metal o un no metal, por ejemplo el óxido nítrico (NO).
Los ácidos, que se forman mediante la reacción de un óxido metálico con agua, también se pueden producir partiendo de un no metal y agua, por ejemplo el ácido clorhídrico HCl.
Las bases que provienen de la unión de un metal con agua como el hidróxido de sodio (NaOH).
Y las sales, las cuales se pueden crear por la interacción de un ácido y una base, de un metal con un ácido o de un metal con un no metal (excepto el oxígeno) como por ejemplo el cloruro de sodio NaCl.
Compuestos orgánicos
El carbono es el elemento base para todos los compuestos orgánicos. A estos compuestos se les llama “orgánicos” porque el carbono está presente en todas las células y organismos vivos. En los compuestos orgánicos prevalecen los enlaces carbono – carbono y carbono – hidrógeno.
También, el carbono se une con facilidad a otros átomos como el nitrógeno, el azufre y los halógenos.
Como vez el carbono posee una gran habilidad para formar enlaces con el mismo y con otros elementos en la tabla periódica por ello existe una gran variedad de compuestos orgánicos que va desde moléculas simples, como el gas metano y hasta complejas, como los lípidos, polímeros, proteínas, etc.
Bibliografía
Aldabe S y Aramendia P. Química 2. Química en acción. Ediciones Colihue SRL. 2004.
Dickerson R. “Principios de Química”. Editorial Reverté. 3era Edid. Barcelona, 1992.
Siga en Sustancias Puras (parte 2)

Trabajo publicado en: Feb., 2020.
Ilustraciones: ChemistryGod, Taranova_ksenya
Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.