Definición de Ley periódica
 La ley periódica es el cimiento de la tabla periódica de los elementos, tal como se denomina al esquema universal que organiza, clasifica y distribuye los diferentes elementos químicos existentes en relación a sus características y propiedades.
La ley periódica es el cimiento de la tabla periódica de los elementos, tal como se denomina al esquema universal que organiza, clasifica y distribuye los diferentes elementos químicos existentes en relación a sus características y propiedades.
Base sobre la cual se asienta la tabla periódica de los elementos
Mientras tanto, la ley periódica dispone que las propiedades físicas y químicas de los mencionados elementos se inclinen a la repetición sistemática conforme aumenta el número atómico de los elementos.
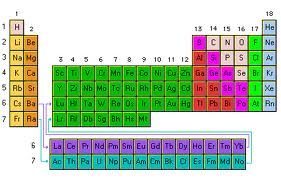
Tabla periódica: organización de los elementos químicos en orden creciente a la cantidad de átomos que dispone cada cual
La tan famosa tabla de los elementos que estudiamos en la escuela, en las materias de física y de química, es un esquema que se ocupa de ordenar a los elementos químicos de acuerdo a su orden creciente en materia de cantidad de átomos.
Las columnas verticales de la tabla se llaman grupos y contiene los elementos con igual valencia atómica y que por ende tienen propiedades símiles, mientras que en las filas horizontales, llamadas como periodos, se agrupan los elementos con propiedades diferentes pero que tienen masas similares.
Cómo se avanzó en este conocimiento: acontecimientos puntuales y graduales
Cabe destacar que todos estos conceptos inherentes a la física y a la química fueron desarrollándose de modo paulatino y progresivo durante el siglo XIX.
Debemos Decir que algunos elementos como la plata (Ag), el oro (Au), el cobre (Cu), el plomo (Pb) y el mercurio (Hg), ya disponían de un perfecto conocimiento desde la antigüedad, el primer descubrimiento científico de un elemento sucedió durante el transcurso del siglo XVII, cuando el alquimista Henning Brand identificó por primera vez al elemento fósforo (P).
En el siglo siguiente, o sea, en el XVIII se empezaron a conocer nuevos elementos, siendo los más relevantes los gases, gracias al desarrollo de la química neumática, entre ellos oxígeno (O), nitrógeno (N) e hidrógeno (H).
Por estos tiempos el químico francés Antoine Lavoisier escribió una lista de sustancias simples en la que aparecían ya 33 elementos.
En los comienzos del siglo XIX la invención de la pila eléctrica desencadenó el estudio de fenómenos químicos nuevos y ello termino generando el descubrimiento de más elementos, como ser los metales alcalinos y los alcalinos-térreos.
Para el año 1830 ya se habían identificado 55 elementos.
En los mediados del siglo XIX, con la invención de un aparato denominado como espectroscopio se hallaron más elementos, especialmente aquellos asociados al color que presentaban sus líneas espectrales, entre ellos el cesio, el talio y el rubidio, por nombrar algunos.
El espectroscopio es un instrumento que sirve para observar y lograr un espectro, siendo que este es el resultado de una dispersión de una serie de radiaciones, de sonidos o fenómenos ondulatorios.
La similitud que presentaban en cuanto a propiedades químicas y físicas determinados elementos llevó a que algunos científicos de esa época se decidiesen a ordenarlos de manera sistemática, a agruparlos siguiendo determinados criterios.
El antecedente más remoto que tenemos de la ley que nos ocupa es la conocida Ley de las octavas, desarrollada por el químico inglés John Alexander Newlands, quien propuso despertando una gran novedad, que cada ocho elementos nos hallamos frente a propiedades símiles.
Este fue el puntapié para que al tiempo formulase su propia tabla periódica publicada formalmente en el año 1863.
Tal como si se estuviese en una carrera de postas, el guante en este sentido lo recogió otro químico, en este caso el alemán Julius Lothar Meyer, quien usando como punto de partida los resultados de Newlands, en el año 1870, determinó los volúmenes atómicos de los elementos.
Una vez que calculó los pesos atómicos y los representó estuvo en condiciones de demostrarle al mundo de la ciencia la confirmación respecto que el peso atómico implica un aumento de las propiedades físicas.
Y casi en simultáneo a los trabajos de Meyer, el químico de origen ruso Dimitri Mendeléyev publica la primera tabla periódica, ganándole de mano a Meyer que lo haría un año después y por tanto es quien se ha quedado con el mérito de ser su creador.
Mendeléyev ordenaría los elementos por orden creciente en función de la masa atómica que presentan, en tanto, situó en una misma columna a aquellos que compartían alguna característica.
Vale mencionarse que para esta época se conocían ya 63 elementos de los 90 existentes.
La tabla se completó a finales del siglo XIX con otro grupo más, denominado cero, y conformado por los gases nobles.
Trabajo publicado en: Jul., 2012.
Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.