Definición de Números Cuánticos

Ingeniera Química
Los números cuánticos se definen como valores enteros que permiten identificar la posición de un electrón dentro del átomo (en la zona extra nuclear de él) y así poder identificarlo.
Los números cuánticos son un conjunto de números representados por letras que, dependiendo de la posición del electrón al que estén referidos, toman distintos valores dentro de un posible rango. A continuación, vamos a describir cada uno de ellos y veremos ejemplos de cómo se aplican según el electrón que deseamos designar.
Número cuántico principal (“n”)
Está íntimamente relacionado con la energía que el electrón posee. A mayor “n”, mayor energía, ya que este número se relaciona con el tamaño del orbital. Matemáticamente, nos indica el período en el electrón se encuentra, y como sabemos a partir de las configuraciones electrónicas de los elementos de la Tabla Periódica, existen físicamente hasta siete niveles de energía. Por ello, “n” puede variar desde uno hasta siete dependiendo de la distancia a la que se ubique el electrón del átomo.
Número cuántico secundario o azimutal (“ℓ”)
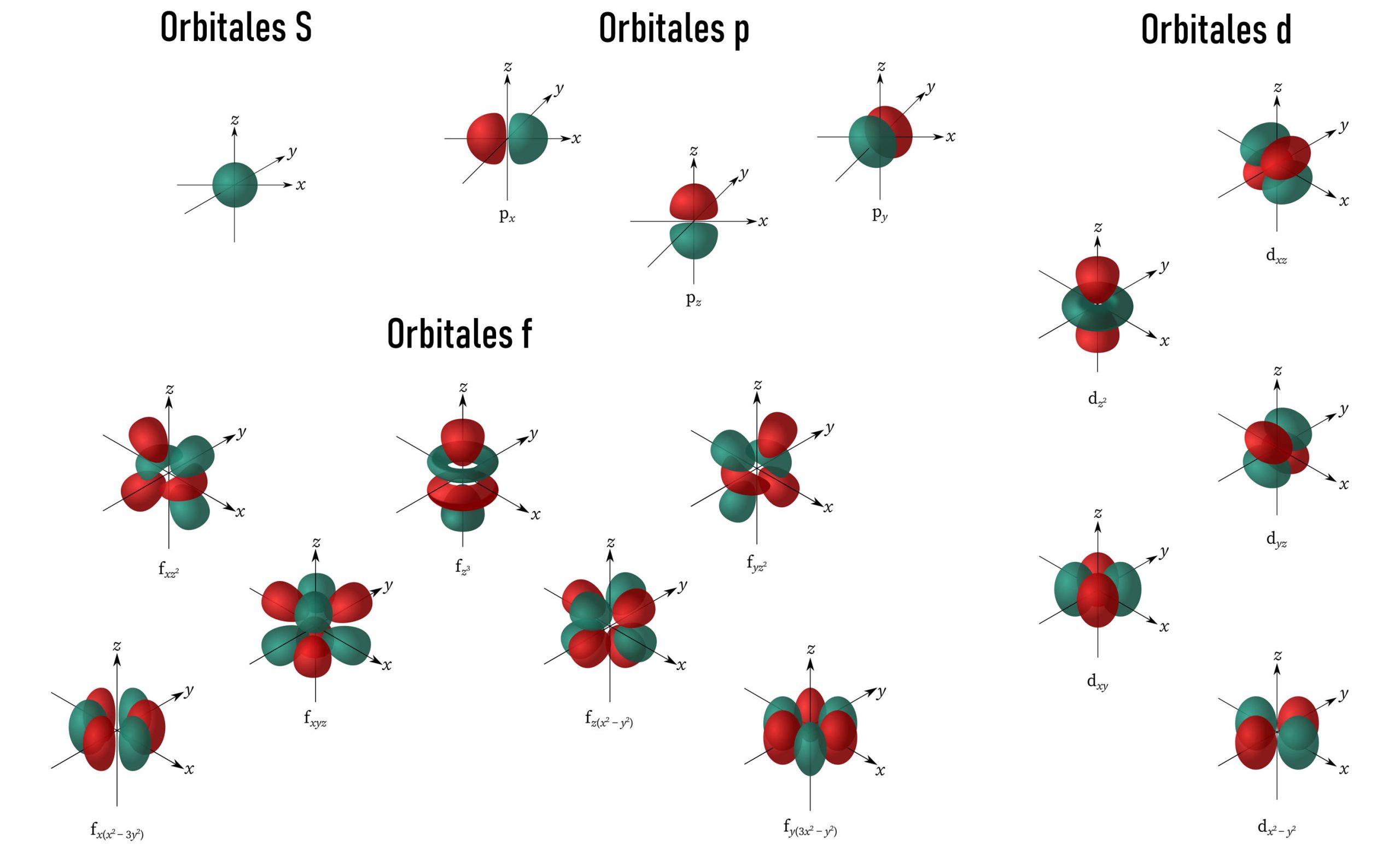
Este número permite identificar el subnivel de energía que está ocupando el electrón, por lo que, nuevamente, a mayor número cuántico azimutal, mayor será la energía que posee el electrón. Matemáticamente, “ℓ” representará los subniveles “s”, “p”, “d” y “f” que identificamos configuraciones electrónicas de los elementos de la Tabla Periódica. Es por ello que, puede tomar valores que van desde cero hasta (“n”-1) siendo “n” el número cuántico principal.
Por ejemplo, si n=1, entonces ℓ únicamente puede valer cero, pues corresponde al subnivel de energía “s”. Mientras que, si n=2, ℓ puede valor tanto cero como uno, ya que nos podemos estar refiriendo a un electrón del subnivel “s” o del subnivel “p” respectivamente. De esta manera identificamos: ℓ=0 para subnivel de energía “s”, ℓ=1 para subnivel de energía “p”, ℓ=2 para subnivel de energía “d” y ℓ=3 para subnivel de energía “f”.
Cabe destacar que, según el “n”, los subniveles de energía “s”, “p”, “d” y “f” pueden sumar orbitales y, por lo tanto, contener más electrones. Por ejemplo, en n=1, ℓ=0 con un único subnivel “s” y un solo orbital que puede contener dos electrones. Para n=2, ℓ=0 con un subnivel “s” o bien ℓ=1 con el subnivel “p” que puede contener tres orbitales y alojar seis electrones.
Para n=3, ℓ=0 con un subnivel “s” o bien ℓ=1 con el subnivel “p” que puede contener tres orbitales y alojar seis electrones o bien ℓ=2 con el subnivel “d” que puede contener cinco orbitales y alojar diez electrones.
Por último, para n=4, ℓ=0 con un subnivel “s” o bien ℓ=1 con el subnivel “p” que puede contener tres orbitales y alojar seis electrones o bien ℓ=2 con el subnivel “d” que puede contener cinco orbitales y alojar diez electrones o bien ℓ=3 con el subnivel “f” que puede contener siete orbitales y alojar catorce electrones.
Si quisiéramos representar estos orbitales en el espacio, su forma sería algo similar a lo siguiente:
Número cuántico magnético (“m”)
Está relacionado con la orientación del orbital en el espacio y se relaciona con la cantidad de orbitales que tiene cada subnivel. Por ello, el valor que toma va desde “-ℓ” hasta “ℓ”. Por ejemplo, para ℓ=1, subnivel “p” contiene hasta 3 orbitales, por lo que “m” adquiere valores como -1, 0 o 1. De igual manera, para ℓ=2 subnivel “d” contiene hasta 5 orbitales, por lo que “m” puede valer: -2, -1, 0, 1 o 2. Análogamente, se completa para ℓ=0 o ℓ=4.
Número cuántico del spin (“s”)
Relacionado con las propiedades magnéticas del electrón y sirven para identificar el sentido de giro de los electrones que están ubicados dentro de un mismo orbital, ya que cada uno de ellos tendrá un signo distinto. Por lo que, “s” puede tomar el valor de +1/2 o -1/2.
Tomemos como ejemplo el Cloro, para identificar números cuánticos en sus electrones alojados en el último nivel de energía. Para ello necesitamos conocer su configuración electrónica, la cual es: 1s2 2s2 2p6 3s2 3p5. Los electrones del último nivel son los alojados en el nivel 3, por lo que: n=3. Luego, ℓ=0 o ℓ=1, para los electrones alojados en subniveles “s” o “p” respectivamente.
Ahora bien, para ℓ=0 (3s2), m=0 y s vale +1/2 y -1/2 respectivamente en cada uno de los electrones allí alojados. Para ℓ=1 (3p5), m=-1,0,1, mientras que s vale +1/2 y -1/2 respectivamente en cada uno de los electrones allí alojados para m=-1 y 0, en tanto que, el orbital designado como m=1 no está completo con dos electrones, por lo que, debemos elegir s= +1/2 o -1/2, según se elija por convención.

Trabajo publicado en: Dic., 2021.
Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.